Fase-diagrama: berrikuspenen arteko aldeak
No edit summary |
No edit summary |
||
| 1. lerroa: | 1. lerroa: | ||
[[Fitxategi:Phase-diag es.svg|thumb|300px|Puntu dun lerroak [[ur]]aren ezohiko jokaera adierazten du. Lerro berdeak [[izozte-puntu]]a adierazten du, eta lerro urdinak berriz [[irakite-puntu]]a. [[Presio]] aldaketak ere agertzen dira.]] |
[[Fitxategi:Phase-diag es.svg|thumb|300px|Puntu dun lerroak [[ur]]aren ezohiko jokaera adierazten du. Lerro berdeak [[izozte-puntu]]a adierazten du, eta lerro urdinak berriz [[irakite-puntu]]a. [[Presio]] aldaketak ere agertzen dira.]] |
||
'''Fase-diagrama''' Fase diagrama bat zientziaren hainbat adarretan erabiltzen den grafiko mota bat da non konposatuen oreka eta [[Fase (termodinamika)|fase]] ezberdinak adierazten diren ezaugarri anitzen (tenperatura, presioa, bolumena…) funtzioan. Fase hauek nahastea osatzen duten substantzien araberakoak izango dira; substantzia puruetan adibidez fase bakoitzak egoera fisiko ezberdinak ([[solido]], [[likido]] eta [[gas]]) adierazten ditu. Osagai bat baino gehiago dituen nahaste batean berriz, fase bakoitzak konposizio ezberdineko zatiak izango dira faseak. |
'''Fase-diagrama''' Fase diagrama bat zientziaren hainbat adarretan erabiltzen den grafiko mota bat da non konposatuen oreka eta [[Fase (termodinamika)|fase]] ezberdinak adierazten diren ezaugarri anitzen (tenperatura, presioa, bolumena…) funtzioan. Fase hauek nahastea osatzen duten substantzien araberakoak izango dira; substantzia puruetan adibidez fase bakoitzak egoera fisiko ezberdinak ([[solido]], [[likido]] eta [[gas]]) adierazten ditu. Osagai bat baino gehiago dituen nahaste batean berriz, fase bakoitzak konposizio ezberdineko zatiak izango dira faseak.<ref>{{Erreferentzia|izena=Petrucci, Ralph|abizena=H.|izenburua=Química general : principios y aplicaciones modernas|argitaletxea=Prentice Hall|data=2011|url=https://www.worldcat.org/oclc/970566679|edizioa=10a ed|isbn=9788483226803|pmc=970566679}}</ref> |
||
== Fase-diagramen puntu interesgarriak == |
== Fase-diagramen puntu interesgarriak == |
||
| 12. lerroa: | 12. lerroa: | ||
Beste puntu berezi bat puntu kritikoa da: |
Beste puntu berezi bat puntu kritikoa da: |
||
* '''Puntu kritikoa eta fluido superkritikoak:''' puntu kritikoan likido/lurrun makurra eten egiten da. Puntu honetatik aurrera egoera likidoa eta gaseosoa berdintsuak dira eta hauek nahastu egiten dira, sistemaren egoera fisikoaren determinazioa zaila eginez. Egoera hau fluido superkritikoa da, non substantziaren dentsitatea likido batena eta likatasuna gas batena diren. Fluido superkritikoak hainbat prozesu industrialetan erabiltzen dira, adibidez [[Karbono dioxido|CO<small>2</small>]] fluido superkritikoaren erabilera kafeari kafeina kentzeko prozesuan. |
* '''Puntu kritikoa eta fluido superkritikoak:''' puntu kritikoan likido/lurrun makurra eten egiten da. Puntu honetatik aurrera egoera likidoa eta gaseosoa berdintsuak dira eta hauek nahastu egiten dira, sistemaren egoera fisikoaren determinazioa zaila eginez. Egoera hau fluido superkritikoa da, non substantziaren dentsitatea likido batena eta likatasuna gas batena diren. Fluido superkritikoak hainbat prozesu industrialetan erabiltzen dira, adibidez [[Karbono dioxido|CO<small>2</small>]] fluido superkritikoaren erabilera kafeari kafeina kentzeko prozesuan.<ref>{{Erreferentzia|izena=Chang,|abizena=Raymond.|izenburua=Química|argitaletxea=McGraw-Hill/Interamericana|data=2007|url=https://www.worldcat.org/oclc/166145950|edizioa=9a ed|isbn=9789701061114|pmc=166145950}}</ref> |
||
{{commonskat|Phase_diagram}} |
{{commonskat|Phase_diagram}} |
||
| 28. lerroa: | 28. lerroa: | ||
Uraren fase diagraman ikus dezakegunez ez daude 3 fase soilik, polimorfismo deitzen zaion fenomenoa gertatzen zaio, hau da, egoera solidoan fase bat baina gehiago ikustea. |
Uraren fase diagraman ikus dezakegunez ez daude 3 fase soilik, polimorfismo deitzen zaion fenomenoa gertatzen zaio, hau da, egoera solidoan fase bat baina gehiago ikustea. |
||
· Bi fase solidoen artean: Aldaketa alotropikoa.<ref>{{Erreferentzia|izena=Atkins, Peter William|abizena=1940-|izenburua=Principios de química los caminos del descubrimiento|argitaletxea=Editorial Médica Panamericana|data=2012|url=https://www.worldcat.org/oclc/981324450|edizioa=5a ed|isbn=9500602822|pmc=981324450}}</ref> |
|||
· Bi fase solidoen artean: Aldaketa alotropikoa. |
|||
== Fase-diagrama nahasteetan == |
== Fase-diagrama nahasteetan == |
||
| 49. lerroa: | 49. lerroa: | ||
Termokimikan Clausius-Clapeyron-en ekuazioa p-t fase diagrama batean fase/egoera ezberdinak banatzen dituzten koexistentzia kurbak determinatzeko erabiltzen da, hauen malda dP/dT -k adierazten du; ∆H fase aldaketaren entalpia izanik eta ∆V berriz bolumena. |
Termokimikan Clausius-Clapeyron-en ekuazioa p-t fase diagrama batean fase/egoera ezberdinak banatzen dituzten koexistentzia kurbak determinatzeko erabiltzen da, hauen malda dP/dT -k adierazten du; ∆H fase aldaketaren entalpia izanik eta ∆V berriz bolumena. |
||
<math>dP/dT=\Delta H/T</math><ref>{{Erreferentzia|izena=Atkins, P. W. (Peter William),|abizena=1940-|izenburua=Química física|argitaletxea=Omega|data=1999|url=https://www.worldcat.org/oclc/49888023|edizioa=6. ed|isbn=8428211817|pmc=49888023}}</ref> |
|||
<math>dP/dT=\Delta H/T</math> |
|||
== Erreferentziak == |
== Erreferentziak == |
||
<references /> |
|||
[[Kategoria:Diagramak]] |
[[Kategoria:Diagramak]] |
||
[[Kategoria:Materiaren egoerak]] |
[[Kategoria:Materiaren egoerak]] |
||
17:36, 11 maiatza 2018ko berrikusketa
Fase-diagrama Fase diagrama bat zientziaren hainbat adarretan erabiltzen den grafiko mota bat da non konposatuen oreka eta fase ezberdinak adierazten diren ezaugarri anitzen (tenperatura, presioa, bolumena…) funtzioan. Fase hauek nahastea osatzen duten substantzien araberakoak izango dira; substantzia puruetan adibidez fase bakoitzak egoera fisiko ezberdinak (solido, likido eta gas) adierazten ditu. Osagai bat baino gehiago dituen nahaste batean berriz, fase bakoitzak konposizio ezberdineko zatiak izango dira faseak.[1]
Fase-diagramen puntu interesgarriak
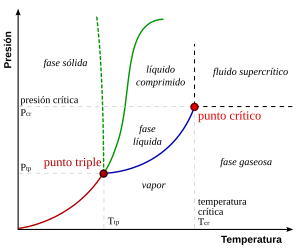
Fase diagrama ohikoenak presio-tenperatura diagramak dira, ordenatu ardatzean presioa eta abzisa ardatzean tenperatura kokatuz.
Orokorrean presio eta tenperatura bakoitzeko fase bakarra (likidoa, gaseosoa edo solidoa) dago, baino puntu hirukoitza zona berezi bat da:
- Puntu hirukoitza: puntu honetan faseak banatzen dituzten hiru makurrak (solido/likido, solido/lurrun eta likido/lurrun makurrak) elkartzen dira. Horren eraginez, puntu honek adierazten dituen baldintzetan hiru faseak orekan aurkituko dira.
Beste puntu berezi bat puntu kritikoa da:
- Puntu kritikoa eta fluido superkritikoak: puntu kritikoan likido/lurrun makurra eten egiten da. Puntu honetatik aurrera egoera likidoa eta gaseosoa berdintsuak dira eta hauek nahastu egiten dira, sistemaren egoera fisikoaren determinazioa zaila eginez. Egoera hau fluido superkritikoa da, non substantziaren dentsitatea likido batena eta likatasuna gas batena diren. Fluido superkritikoak hainbat prozesu industrialetan erabiltzen dira, adibidez CO2 fluido superkritikoaren erabilera kafeari kafeina kentzeko prozesuan.[2]
| Wikimedia Commonsen badira fitxategi gehiago, gai hau dutenak: Fase-diagrama |
Sustantzia puruen fase-diagrama
Diagrama mota ezberdinak aurki ditzakegu materialen arabera, hauek egoera likido eta solidoan duten disolbagarritasun ezberdinengatik. Kasu bereziak ere aurki daitezke; hauetatik identifikatzeko errazenetako bat iodoaren fase diagrama izanik. Bertan faktoreen jakin batzuen arabera kristalizazio egoeren aldaketek faseen arteko eremuak definitzen dituzte.
· Grafikoan tenperatura eta presioaren araberako aldaketak adierazten dira.
· Fase solido eta likido artean: Fusio eta hauspeatze puntuak.
· Fase solido eta gaseoso artean: Sublimazio eta alderantzizko sublimazio puntuak.
· Fase likido eta gaseoso artean: Lurruntze eta kondentsazio puntuak.
Uraren fase diagraman ikus dezakegunez ez daude 3 fase soilik, polimorfismo deitzen zaion fenomenoa gertatzen zaio, hau da, egoera solidoan fase bat baina gehiago ikustea.
· Bi fase solidoen artean: Aldaketa alotropikoa.[3]
Fase-diagrama nahasteetan
Nahaste bat dugunean fase diagrama konplexuagoak izan ditzakegu. Kasu hauetan, kontzentrazioa aldagai oso garrantzitsua bihurtzen da. Nahasteen fase diagrametan ere hainbat aldagai izan ditzakegu, tenperatura, presioa, konposizioa, eremu elektrikoaren indarra…
Ohikoenetakoa den fase diagrama bat tenperatura bi sustantzien kontzentrazio erlatiboen funtzioan adierazten duena da. Nahastea mota desberdinetakoa izan daiteke, soluzio solidoa, nahaste eutektikoa besteen artean. Beste mota bateko diagrama bat “irakite tenperaturen diagrama” da 2 osagaietako nahasteentzat. Diagrama hauetan presio jakin batean bi sustantziako nahaste lurrunkor baten lurrunaren konposizioa eta likidoaren konposizioaren oreka adierazten da. Diagrama gehienetan tenperatura ardatz bertikalean irudikatuz eta nahastearen konposizioa ardatz horizontalean.
Bestalde, aipatutako diagramez gain beste konbinazio pila dira posible.
Sistemak nahaskorrak, erdi nahaskorrak edo nahastezinak izan daitezke:
- Sistema nahaskorrak: bi substantzia edozein proportzioan nahasterakoan fase bakarra eratzen da (adibidez ura eta etanola).
- Sistema erdi nahaskorrak: bi substantziak partzialki nahasten dira, fase bakar bat eratu gabe eta bi faseak ondo bereizi gabe (adibidez ura eta 1-butanola). Sistema erdi nahaskorren fase diagraman tenperatura (T) kontzentrazioaren (xB) funtzioan irudikatzen da, presioa (P) konstante mantentzen delarik. Fase diagraman kurba baten bidez fase bakarreko zonaldea eta bi fasetako zonaldea banatzen dira.
- Sistema nahastezinak: substantziak ez dira nahasten, bi faseak ondo bereiziz (ura eta olioa).
Substantziak nahaskorrak izan daitezke fase batean (adibidez fase likidoan) eta nahastezinak beste batean (adibidez fase solidoan).
Clausius-Clapeyron-en ekuazioa
Termokimikan Clausius-Clapeyron-en ekuazioa p-t fase diagrama batean fase/egoera ezberdinak banatzen dituzten koexistentzia kurbak determinatzeko erabiltzen da, hauen malda dP/dT -k adierazten du; ∆H fase aldaketaren entalpia izanik eta ∆V berriz bolumena.
Erreferentziak
- ↑ H., Petrucci, Ralph. (2011). Química general : principios y aplicaciones modernas. (10a ed. argitaraldia) Prentice Hall ISBN 9788483226803. PMC 970566679..
- ↑ Raymond., Chang,. (2007). Química. (9a ed. argitaraldia) McGraw-Hill/Interamericana ISBN 9789701061114. PMC 166145950..
- ↑ 1940-, Atkins, Peter William. (2012). Principios de química los caminos del descubrimiento. (5a ed. argitaraldia) Editorial Médica Panamericana ISBN 9500602822. PMC 981324450..
- ↑ 1940-, Atkins, P. W. (Peter William),. (1999). Química física. (6. ed. argitaraldia) Omega ISBN 8428211817. PMC 49888023..

