Karbono
| Karbonoa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 Boroa ← Karbonoa → Nitrogenoa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ezaugarri orokorrak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izena, ikurra, zenbakia | Karbonoa, C, 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie kimikoa | ez-metalak | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Taldea, periodoa, orbitala | 14, 2, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomikoa | 12,0107 g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurazio elektronikoa | 1s2 2s2 2p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroiak orbitaleko | 2, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate fisikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egoera | solido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dentsitatea | (0 °C, 101,325 kPa) (grafitoa) 1,9-2,3 g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Urtze-entalpia | (grafitoa) 100 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Irakite-entalpia | 715 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bero espezifikoa | (25 °C) (grafitoa) 8,517 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lurrun-presioa
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate atomikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristal-egitura | (grafitoa) hexagonala | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidazio-zenbakia(k) | 4, 3, 2, 1, 0, -1, -2, -3, -4 (oxido azido ahula) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatibotasuna | 2,55 (Paulingen eskala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizazio-potentziala | 1.a: 1.086,5 kJ/mol 2.a: 2.352,6 kJ/mol 3.a: 4.620,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio atomikoa (batezbestekoa) | 70 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio atomikoa (kalkulatua) | 67 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio kobalentea | 77 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsen erradioa | 170 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Datu gehiago | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eroankortasun termikoa | (300 K) 7,81 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soinuaren abiadura | 5150 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopo egonkorrenak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Karbonoaren isotopoak
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Karbono (Latinetik carbo, "ikatz") edo ikazkaia[1] elementu kimiko bat da, ikurra C eta zenbaki atomikoa 6 dituena. Taula periodikoan, 14. taldeko eta 2. periodoko elementu tetrabalente ez-metalikoa da. Naturan karbonoaren hiru isotopo daude: 12C eta 13C egonkorrak dira, baina 14C erradioaktiboa da eta bere semidesintegrazio-periodoa 5730 urtekoa da.[2] Karbonoa antzinatik ezagutzen den elementuetako gutxietako bat da eta kimika organikoaren oinarria.[3]
Unibertsoan 4. elementurik ugariena da, hidrogenoa, helioa eta oxigenoaren ondoren. Lurrazalean 15. elementu ugariena da, non aurkitu daitekeen egoera elementalean (ikatza eta diamantea), eta baita konposatu inorganiko (karbono dioxidoa, karbono monoxidoa, karbonatoak)[4] eta organiko askotan ere (biomasa, petrolio, gas naturalean).[5] Bizitzaren forma guztietan dago, eta giza gorputzean bigarren elementurik arruntena da masan oxigenoaren ondoren.[6] Ugaritasun honek, osatzen dituen konposatu organiko guztiekin eta polimeroak eratzeko duen ahalmenarekin batera, bizi-mota ezagun guztien oinarrizko elementu kimikoa izatea eragin du.
Hainbat forma alotropiko dauzka, ezagunenak grafitoa, diamantea eta karbono amorfoa.[7] Karbonoaren propietate fisikoak oso aldakorrak dira forma alotropikoaren arabera. Adibidez, grafitoa opakoa eta beltza da, diamantea oso gardena den bitartean. Grafitoa ahula da, nahikoa paper batean idazteko (hortik datorkio "γράφειν" izena, "idatzi"), eta diamantea naturan dagoen mineral ezagunik gogorrena da. Grafitoa eroale elektriko ona da, diamantea oso eroale txarra den bitartean. Egoera normalean, diamanteak, karbonozko nanotutuek eta grafenoak material ezagunen artean eroankortasun termikorik altuenak dituzte. Karbonoaren alotropo guztiak solidoak dira baldintza normaletan, kimikoki egonkorrak dira eta tenperatura oso altua behar dute erreakzionatzeko.
Konposatu inorganikoetan aurki daitekeen oxidazio egoerarik ohikoena +4 da, karbono dioxidoan eta karbonatoetan, baina karbono monoxidoan eta trantsizio-metalekin osatutako karboniloetan +2 oxidazio-egoeran ageri da. Karbono inorganikoaren iturri nagusiak kareharria, dolomita eta karbono dioxidoa dira, baina ikatz, zohikatz, petrolio eta metano hobietan ere kopuru nabarmena dago.[8] Karbonoak beste edozein elementuk baino konposatu gehiago eratzen ditu: orain arte hamar milioi konposatu organiko deskribatu dira,[9] eta hala ere, baldintza estandarretan sor daitezkeen mota honetako konposatu posible guztien ehuneko txikia osatzen dute. Horregatik, karbonoari "elementuen erregea" izena ematen zaio.[10]
Aurrehistoriatik karbonoaren errekuntzaren produktuak garapen teknologikoaren oinarria izan dira. Gaur ere, karbonotan oinarritutako materialak teknologiaren arlo askotan oso erabiliak dira: material konposatuak, litio-ioi bateriak, ur eta airearen arazketan, arku-labeen elektrodoak, metalgintzan…
Ezaugarriak[aldatu | aldatu iturburu kodea]
Karbono atomoen kimikak mekano baten itxura dauka. Naturak berak bizirako molekulak sortzen ditu, karbono-atomoak arau batzuen arabera konbinatuta eta beste atomo batzuk gehituta.
Karbonoaren konfigurazio elektronikoa 1s22s22p2 da, edo [He]2s22p2.[11] Atomo neutro bakoitzak 4 balentzia-elektroi ditu funtsezko egoeran, elektroi pare bat 2s orbitalean eta beste pare bat 2p orbitaletan. Hala ere, beste atomo batzuekin lotura kobalenteak sortu ahal izateko, balentzia-elektroien orbitalek hibridazioa jasan behar dute. Hau da, geometria ezagunak dituzten nolabaiteko orbital tartekariak eratzen dira, sp3, sp2 eta sp orbital hibridoak.[12]
- sp3 hibridazioa - Karbono atomo batek geometria tetraedrikoan lau lotura bakun osatu behar dituenean gertatzen da, metanoan CH4 adibidez. 2s orbital atomikoa eta 2p hiru orbital atomikoak konbinatzen dira lau sp3 orbital hibridoak eratzeko. Lau orbital hibridoak aurrez aurreko gainezarpenen bidez atomo desberdinetako beste lau orbitalekin konbinatuko dira, eta lau lotura kobalente bakun (σ-motakoak) osatuko dira.
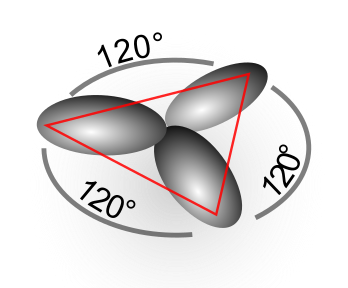
- sp2 hibridazioa - Bi lotura bakun eta bikoitz bat geometria triangeluar launean osatzen direnean gertatzen da, etenoan CH2=CH2 adibidez. Kasu honetan, 3 orbital atomiko (2s + 2px + 2py) hibridatzen dira, pz orbitala hibridatu gabe geratuz. Hiru sp2 orbital hibridoak aurrez aurreko gainezarpenen bidez atomo desberdinetako beste hiru orbitalekin konbinatuko dira. Honetaz gain, hibridatu gabeko pz orbitala, albo-gainezarpen baten bidez beste atomo baten orbital batekin ere konbinatu daiteke. Horrela, C bakoitzak sp2 hibridazioan lotura bikoitz bat eratu dezake, σ lotura batez eta π lotura batez osatua. Guztira, bi lotura kobalente bakun eta lotura bikoitz bat osatuko dira.
- sp hibridazioa - Lotura bakun eta hirukoitz bat geometria linealean osatzen direnean gertatzen da, etinoan CH≡CH adibidez. Kasu honetan, 2s eta 2px orbitalak hibridatzen dira, bi sp orbital sortuz, eta py eta pz orbitalak hibridatu gabe utziz. Bi sp orbital hibridoak aurrez aurreko gainezarpenen bidez atomo desberdinetako beste bi orbitalekin konbinatuko dira. Honetaz gain, hibridatu gabeko py eta pz orbitalak, albo-gainezarpenen bidez beste bi atomoren orbitalekin ere konbinatu daitezke. Horrela, C bakoitzak sp hibridazioan lotura hirukoitz bat era dezake, σ lotura batez eta 2π loturez osatua (CH≡CH).
-
sp3 orbital hibridoak
-
sp2 orbital hibridoak
-
sp orbital hibridoak
Karbonoak lotura bikoitzak eta hirukoitzak ezartzeko erraztasun handia azaltzen du, bere taldeko beste elementuek ez bezala. Erraztasun hau bere tamaina txikiaren baitan dago, π loturak osatzen dituzten albo-gainezarpenak egon daitezen, hibridatu gabeko orbitalek nahiko hurbil egon behar dutelako. Hau dela eta, handiagoak diren talde bereko elementuek, hala nola silizioak, zailtasun handiak dituzte π loturak ezartzeko.[13]
Pauling-en eskalan, karbonoaren elektronegatibotasuna 2,55-ekoa da. Hau da, oxigenoak edo fluorrak ez bezala, karbonoak ez du loturaren elektroiak erakartzeko joera handirik. Horren ondorioz, bere loturak polarizatu gabeko lotura kobalenteak izaten dira.
Bestetik, bere elektronegatibotasun ertainaren ondorioz, karbonoak erraztasun handia dauka beste elementuekin zein beste karbono atomoekin loturak ezartzeko. Hona hemen zenbait loturen entalpiak:[11]
| Elementua | Lotura entalpia (kJ·mol−1) | ||
|---|---|---|---|
| Bakuna | Bikoitza | Hirukoitza | |
| H | 414 | — | — |
| C | 347 | 620 | 812 |
| N | 276 | 615 | 891 |
| O | 351 | 745 | — |
| F | 488 | — | — |
| P | 263 | — | — |
| S | 255 | 477 | — |
| Cl | 327 | — | — |
Isotopoak[aldatu | aldatu iturburu kodea]
Karbono naturalak bi isotopo egonkor ditu, 12C (%98,89) eta 13C (%1,11), eta hirugarren bat (14C) erradioaktiboa. Azken honen erdibizitza-denbora 5760 urtekoa da.[14]
1961an IUPACek 12C isotopoaren masa elementuen masa atomikoen eredutzat ezarri zuen.[15]
Karbono-14 isotopo erradioaktiboa desintegratuz doan arren, aldi berean atmosferako goialdean etengabe ekoizten ari da:
147N + 10n → 146C + 11H
Oreka honetan oinarrituz, jatorri organikoa duten laginen datazioan erabiltzen da.[16][17]
Alotropoak[aldatu | aldatu iturburu kodea]

Karbono elementalak hainbat substantzia osa ditzake, bakoitzaren egitura kristalinoa bereizgarria delarik, hauek, karbono alotropoak dira. Karbonoaren alotropo desberdinak ezagunak dira, garrantzitsuenak diamantea, grafitoa, londsdaleita, fullerenoak [18] karbonozko nanotutuak[19] eta grafenoa izanik. Baina baldintza estandarretan (298,15 K eta 100 kPa), grafitoa da termodinamikoki alotroporik egonkorrena. Hala ere, alotropo guztiak oso egonkorrak dira eta soilik tenperatura oso altuetan erreakziona dezakete.[20][21]
Karbonoaren propietate fisikoak bere forma alotropikoaren araberakoak dira. Esate baterako, diamantea eta grafitoa baldintza normaletan solidoak dira; diamantea solido gardena eta grafitoa opakua eta beltza; diamantea mineral gogorrenetarikoa da eta grafitoa paperan marra bat uzteko bezain biguna da; diamanteak isolatzaile elektriko da eta grafitoa eroalea. Bestetik, diamanteak eroankortasun termikorik altuena duen minerala da.
Diamantea[aldatu | aldatu iturburu kodea]
Diamantea solido oso gogorra da, kolorgea, gardena, isolatzaile elektrikoa eta beroaren eroale oso ona. 3D solido kobalentea eta tetraedroetan oinarritutako egitura du. Soilik C-C lotura kobalenteak ditu non C atomoa sp3 hibridazioan dagoen. Lotura kobalenteen ondorioz, elektroien higikortasuna ez da suertatzen eta isolatzaile elektrikoa da; bere fusio-tenperatura 3500 °C-koa da eta bere dentsitatea 3,5 g · cm−3. Material urratzailea da eta bere gogortasunagatik erremintak egiteko erabiltzen da.

Diamante arruntean tetraedroek paketatze kubikoa azaltzen dute, baina tenperatura eta presioa oso altuetan tetraedroek paketatze hexagonala ere har dezakete, lonsdaleita mineralean. [22]
Diamante naturalak karbonoa presio eta tenperatura altuetan egon den metakinetan sortu dira. Diamantea naturala izateaz gain, diamante sintetikoak ere grafitotik sintetizatu daitezke tenperatura eta presio altuetan.
Grafitoa[aldatu | aldatu iturburu kodea]
Grafitoa karbonoaren alotropo termodinamikoki egonkorrena da. Karbono amorfo natural gehiena guztiz kristalinoa ez den grafitoa da, hauxe, ikatz gehienetan eta kedarrean dagoen egitura da.
Grafito kristalinoak egitura bidimentsionala (2D) du non C bakoitza beste hiru C atomoekin lotuta dagoen sp2 hibridazioan geometria triangeluar lauean. Horrela, xafletan karbonoren eraztun hexagonalak daude non C=C distantzia (141 pm) lotura kobalente bikoitzarena den. Horren ondorioz, bentzenoan bezala, geruzetatik zehar p elektroi deslekutuak daude, eta grafitoa eroalea da. Beste alde batetik, xaflen arteko distantzia handiagoa (335 pm) da, hots, geruzen arteko loturak askoz ahulagoak dira, eta ez dira kobalenteak, Van der Waals loturak baizik. Hau dela eta, grafitoa esfoliatzea edo xafletan banatzea erraza da eta lubrifikatzaile ona da.
Grafitoaren 2D-egitura dela-eta, propietate bereziak ditu, hala nola, eroankortasun anisotropikoa. Hau da, geruzetatik zehar eroalea da baina isolatzailea eroankortasuna xaflekiko perpendikularki neurtzen bada.
Grafitoa meategietatik ateratzeaz gain, karbono amorfotik ere kristaldu daiteke, 2500 °C-tan. Lubrifikaitzailea da, eta elektrodoak eta arkatzak (buztinarekin batera) egiteko erabiltzen da.
Fulerenoak[aldatu | aldatu iturburu kodea]

Fulerenoak 1985. urtean aurkitu ziren.[18] Bere egiturak grafitoren antza du baina karbonoz osaturiko pentagonoak eta hexagonoak konbinatzen ditu egitura esferikoak edo ia esferikoak (C20, C60, C70...) dituzten molekulak eratzeko. Molekula hauetan, C atomoek sp3 edo sp2 hibridazioak dituzte. Egitura egonkorrena C60-a da, eta futbol baloi baten egitura du. Fullerenoak laborategian prestatu dira grafitotik abiatuz: C (grafito) → C60 (1000 °C-tan eta laser batez irradiatuz)
Solido molekularren propietate tipikoak azaltzen dituzte: tenperatura igotzean sublimatu egiten dira, dentsitate baxua dute, 1,5 g · cm-3 eta isolatzaile elektrikoak dira. Gainera, diamantea eta grafitoa ez bezala, fullerenoak solugarriak izaten dira disolbatzaile apolarretan. Solido beltzak izan arren, disoluzioan kolore desberdinak hartzen dituzte, hala nola, C60 morea, C70 gorria, C76 berde-horixka.
Grafenoa eta karbonozko nanotutuak[aldatu | aldatu iturburu kodea]

Grafenoak eta karbonozko nanotutuek[23] ere grafitoren egitura dute oinarri. Grafenoa grafitoren xafla bakarrak dira eta karbonozko nanotutuak grafeno-xaflak zilindrikoki kiribilduak. Grafenoa bidimentsionala 2D da eta nanotutuak luzeak izaten dira eta 1D edo egitura monodimentsionalak kontsideratzen dira. Nanotutuak irekiak zein itxiak izan daitezke, egitura itxiak fullerenoaren egitura dute hodiko bazterretan. Zilindroak edo tutuak ere geruza bakarrekoak eta geruza anitzekoak izan daitezke, propietate fisikoak aldatuz. Gainera, grafeno-xaflak kiribiltzeko norantza ere desberdina izan daiteke. Guzti hau dela eta, propietate fisiko oso desberdinak azaldu ditzakete eta garrantzi handikoak dira nanoteknologia arloan.
Azkenik, badaude guztiz kristalinoak ez diren beste forma batzuk: kokea, energiaren iturri eta erreduzitzaile moduan erabiltzen dena, karbono beltza (tinta edo pigmento eta gomak egiteko), karbono aktibatua (gainazal handia 103 m2 · g-1 eta zurgatzaile ona) eta karbonozko zuntzak.
Ugaritasuna[aldatu | aldatu iturburu kodea]
Karbonoa ez zen Big Bang-ean sortu, izarretan baizik. Hau dela eta, karbonoa ugaria da izarretan, kometetan eta beste planeten atmosferetan.[24]
Grafitoa Errusian, Estatu Batuetan, Mexikon, Groenlandian eta Indian dago kantitate handitan. Diamante naturalak arroka bolkanikoekin batera (kimberlita eta lamproita) agertzen dira. Diamanteen metakin handienak Afrikan (Hegoafrika, Namibia, Botsuana, Kongo Errepublika eta Sierra Leona) daude. Hauetaz gain, Kanadan, Errusian, Brasilen eta Australian ere metakin garantzitsuak daude.
Beste elementuekin konbinatuta, lurrazaleko atmosferan dago (CO2), uretan disolbatuta (HCO3−) eta mineral solido askotan (kaliza, dolomita, marmol, etabar).
Izarretako nukleosintesia[aldatu | aldatu iturburu kodea]
Karbonoaren zikloa[aldatu | aldatu iturburu kodea]
Konposatuak[aldatu | aldatu iturburu kodea]
Konposatu organikoak[aldatu | aldatu iturburu kodea]
Karbonoak oso lotura kobalente egonkorrak era ditzake beste karbono batekin. Ondorioz, konposatu asko eta asko era daitezke, eta horixe da, hain zuzen, kimika organikoaren oinarria. Izan ere, ezagutzen diren konposatu guztien artean, %95 konposatu organikoak dira. Gaur egun, 16 milioi konposatu organiko ezagutzen dira, eta konposatuen egiturak askotarikoak izan daitezke. Egitura-aniztasun horrek beste ondorio hau dakar: iturri naturaletatik eskuratutako eta laborategian prestaturiko konposatu organiko ugari daude aktibitate biologikoa dutenak. Hala, izaki bizidunek osatzen dituzten konposatu kimiko gehienak konposatu organikoak dira; hala nola azukreak, proteinak, lipidoak, azido nukleikoak eta abar. Orobat, bizitza sortzen duten prozesu kimikoak erreakzio organikoak dira.[25]
Konposatu inorganikoak[aldatu | aldatu iturburu kodea]
Karbonoa agente erreduzitzaile aktiboa denez, elementu askorekin erreakziona dezake, bai metalekin bai ez-metalekin konposatu asko eta oso desberdinak emateko,[8][21]
Oxidoak[aldatu | aldatu iturburu kodea]
Karbono monoxidoa[aldatu | aldatu iturburu kodea]
Karbono monooxidoa, CO, gas kolorgea, usaingabekoa eta toxikoa da. Errekuntzetan ekoizten da oxigeno gutxi dagoenean, eta laborategian ere azido formikotik lortu daiteke:
C (s) + ½ O2 (g) → CO (g)
HCOOH (l) + H2SO4 (l) → CO (g) + H2O (l) + H2SO4 (aq)

Karbono monooxidoa erreduzitzaile ona da eta nahiko erreaktiboa:
2 CO (g) + O2 (g) → 2 CO2 (g) (∆H° = −565 kJ/mol, erregaia da)
CO (g) + Cl2 (g) → COCl2 (g)
3 CO (g) + Fe2O3 (s) → 3 CO2 (g) + 2 Fe (l) (Metalgintzan)
Kontzentrazio altuetan gas toxikoa da oxigenoaren ordez hemoglobinari lotzen baitzaio.
Karbono dioxidoa[aldatu | aldatu iturburu kodea]
Karbono dioxidoa, CO2, erretzen ez den gas dentsua da, eta suteak itzaltzeko erabili daiteke. Presio atmosferikoan solidotik gasara zuzen sublimatzen da eta likidoa garraiatzeko ontzietan presiopean gorde behar da. Presioa askatzean likidoa baporizatzen da energia zurgatuz eta tenperatura jaitsiz, honen ondorioz izoztu egiten da, izotz lehorra deritzona lortuz.
Uretan arinki solugarria da azido karbonikoa emateko, beraz, gas hau azidoa da:

CO2 (g) + H2O (l) ↔ H2CO3 (aq) ↔ HCO3- (aq) + H3O+ (aq)
Laborategian erraz lor daiteke karbonato basikoetatik:
2 HCl (aq) + CaCO3 (s) → CaCl2 (aq) + CO2 (g) + H2O (l)
Industrian oso garrantzitsua da, hotzailea, edariak karbonatatzeko, aerosoletan, extintoretan.
Negutegi efektuaren eragile nagusia da CO2-a. Erregai fosilen errekuntzen ondorioz, beste gas batzuekin batera, atmosferan metatuz doa eta lurrazalak askatzen dituen infragorri izpiak zurgatzen ditu, gure atmosferako tenperatura igoz.
Haluroak eta klorofluorokarbonoak[aldatu | aldatu iturburu kodea]
Karbono tetrahaluroak CF4, CCl4, CBr4, CI4 oso inportanteak dira beste konposatu batzuk sintetizatzeko, hala nola, CHCl3 (kloroformoa) eta karbonil-haluroak COX2 (CO + Cl2 → Cl2C=O)
CFCl3, CF2Cl2, CF3Cl konposatuei freons edo CFC deritzegu, hauek hotzaile gisa eta aerosoletan erabiltzen hasi ziren baina gaur egun ingurunea erasotzen dutela badakigu. Atmosferako goialdean argi ultramorearen ondorriz oso erreaktiboak diren erradikalak askatzen dituzte eta ozono geruza erasotzen dute:
CF3Cl → Cl
Cl + O3 → O2 + ClO
Karburoak[aldatu | aldatu iturburu kodea]
Beste elementu batekin konbinatzean sortzen den konposatu binarioari karburo deritzogu. Solido gogorrak dira eta fusio-tenperaturak oso altuak dituzte.
Metal elektropositiboekin, alkalino, lurralkalino eta aluminioarekin karburo estekiometrikoak eta ionikoak sortu daitezke. Gehienetan dikarburo (−2) ioia C22− dago eta batzuetan, Be2C, Al4C3, C4- ioia. Karburoak oso erreaktiboak dira (CaC2).
Karburo kobalenteak gutxi dira, SiC eta B4C, urragarriak, solido oso gogorrak eta erremintak egiteko erabiltzen dira.
Aleazio metalikoetan ere karbonoa metalaren paketatze trinkoan sartzen da, hutsuneetan, hauek zirrikituetako karburoak dira. Metalen propietateak dituzte, itxura metalikoa eta eroale elektriko onak baina metalak baino fusio-tenperatura altuagoak dituzte eta gogorragoak dira, gainera metal puruak baino kimikoki geldoagoak ere badira.
Historia eta etimologia[aldatu | aldatu iturburu kodea]
Karbonoa aurrehistorian aurkitua izan zen eta antzinatik ezaguna da, material organikoen errekuntza osatugabean erraz lortzen baitzen. Jadanik 1704an, Newton-ek diamantea erregaia izan litekeela proposatu zuen, baina 1772ra arte ez zen lortu diamante bat erretzen. Esperimentu honetan Lavoisier-ek errekuntzaren produktua CO2 gasa zela demostratu zuen eta azkenik, 1797an diamantea karbono purua zela Tennant-ek zehaztu zuen.
Karbonoaren isotopo ugariena 12C, IUPAC-ek 1961an pisu atomiken oinarritzat aukeratu zuen 16O-aren ordez, eta zehazki 12-ko masa atomikoa esleitu zioten.
Karbonoaren lehenengo konposatuak bizidunetan aurkitu ziren XIX. mendearen hasieran, eta hau dela eta karbonoaren konposatuaren kimikari kimika organikoa esaten zaio.
XX. mendean, 1985. urtean, fullerenoak (C60) aurkitu ziren[26] eta 1991an, karbonozko nanotutuak.
Erabilerak[aldatu | aldatu iturburu kodea]
Industria-mailan karbonoaren konposatu erabilienak hidrokarburoak dira, batez ere erregai fosilak, hala nola, petrolioa eta gas naturala. Petrolioaren findegitik gasolinak, kerosenoa eta olioak lortzen dira, material plastikoen lehengai erabiliena petrolioa da. Bestetik, gas naturalaren errekuntza energiaren iturri nagusia da.
Karbonoaren beste erabilera garrantzitsu batzuk:
- Karbono-14 isotopo erradioaktiboa datazioan erabiltzen da.
- Grafitoa buztinekin batera arkatzen minak egiteko erabiltzen da. Industrian, lubrifikatzaileen gehigarria da.
- Diamantea bitxigintzan oso erabilia da eta bere gogortasuna dela eta ebaketa-erremintak egiteko erabiltzen da.
- Altzairuen osagaia da.
- Erreaktore nuklearretan material babeslea da, neutroien zurgatzailea baita.
- Medikuntzan, “karbonozko pilulak” digestio-aparatuan toxinak zurgatzeko erabiltzen dira.
- Karbono aktibatua ura iragazteko eta purifikatzeko erabiltzen da.
- Kedar edo karbono amorfoa gomaren sintesian erabiltzen da gomaren propietate mekaniko hobeak lortzeko. Fullurenoen sintesian eta elektrodoen fabrikazioan ere erabiltzen da.
- Karbonozko zuntzak oso erresistenteak dira eta nagusiki tenis-erraketak egiteko erabiltzen dira. Erresistentzia altuko eta pisu arineko materialak egiteko ere erabiltzen dira, esate baterako, bizikletak.
- Nanoteknologian, bai fullerenoak bai nanotutuak bai grafenoa interes handiko materialak dira.
Arriskuak[aldatu | aldatu iturburu kodea]
Karbono eta bere konposatuak toxikoak izan daitezke. Karbono monoxidoa, errekuntza askotan askatutako gasa, eta zianuroak (CN−) oso toxikoak izan daitezke ugaztunentzat. Konpusatu organikoen gas batzuk, eteno, etino eta metanoa, sukoiak eta leherkorrak izan daitezke airean. Baina beste alde batetik, karbonoaren konposatu asko oinarrizkoak dira bizidunentzat.
Karbono puruak toxizitate ia nulua dauka gizakiengan, kantitate txikietan grafito edo ikatz gisa maneiatu eta irentsi ere egin daiteke. Karbonoak ez du erraz erreakzionatzen ezta disolbatzen ere, hau dela eta, digestio-traktuan sartu ezkero ez da erraz kanporatzen. Karbono-beltza pigmentu gisa erabili da betidanik. Hala ere, karbon edo kedar hautsa kantitate handitan arnastea arriskutsua izan daiteke, birikien ehunak narrita baititzake. Neumokoniosis izeneko gaisotasuna ohikoa da ikatz-meatzarien artean. Era berean, diamante hautsa ere kaltegarria izan daiteke arnaztean edo irenstean. Erregaien errekuntzetan askatzen diren ikatz mikropartikulek ere birikietan kalteak sortu ditzakete.[27] Bestetik, karbonoren metaketa handiek, oxigenorik gabeko atmosferantan miloika urtetan egon direnek, berez su hartu dezakete airean jartzean.
Karbonoren konposatuen artean pozoi hilgarriak ere badaude, hala nola, tetradotoxina, errizino-hazietan, zianuroa (CN−) eta karbono monoxidoa.
Erreferentziak[aldatu | aldatu iturburu kodea]
- ↑ «ikazkai - Elhuyar hiztegiak» hiztegiak.elhuyar.eus (Noiz kontsultatua: 2018-12-08).
- ↑ «WebElements Periodic Table » Carbon » the essentials» www.webelements.com (Noiz kontsultatua: 2018-12-08).
- ↑ History of Carbon. .
- ↑ (Ingelesez) Organic Chemistry - LibreTexts. .
- ↑ (Ingelesez) Abundance of elements in Earth's crust. 2019-03-27 (Noiz kontsultatua: 2019-04-03).
- ↑ Reece, Jane B.. Campbell biology. (Tenth edition. argitaraldia) ISBN 9780321775658. PMC 849822337. (Noiz kontsultatua: 2019-04-03).
- ↑ «World of Carbon» web.archive.org 2001-05-31 (Noiz kontsultatua: 2018-12-08).
- ↑ a b Greenwood, N. N. (Norman Neill). (1997). Chemistry of the elements. (2nd ed. argitaraldia) Butterworth-Heinemann ISBN 0750633654. PMC 37499934. (Noiz kontsultatua: 2019-04-03).
- ↑ Chemistry Operations (15 de diciembre de 2003). «Carbon». Los Alamos National Laboratory. Archivado desde el original el 13 de septiembre de 2008. Consultado el 9 de octubre de 2008]
- ↑ Demming, Anna. (2010-07-30). «King of the elements?» Nanotechnology 21 (30): 300201. doi:. ISSN 0957-4484. (Noiz kontsultatua: 2019-04-03).
- ↑ a b Kimika II. Giltza. Edebé argitaletxea.
- ↑ Housecroft, Catherine E., 1955-. (2012. +). Inorganic chemistry. (4th ed. argitaraldia) Pearson ISBN 9780273742753. PMC 775664094. (Noiz kontsultatua: 2019-04-03).
- ↑ S.E. Gould. Shine on you crazy diamond: why humans are carbon-based lifeforms. Scientific American. 2012ko azaroaren 11.
- ↑ «WebElements Periodic Table » Carbon » isotope data» www.webelements.com (Noiz kontsultatua: 2019-04-03).
- ↑ «BIPM - SI base units» www.bipm.org (Noiz kontsultatua: 2019-04-03).
- ↑ Bowman, Sheridan.. (1990). Radiocarbon dating. Published for the Trustees of the British Museum by British Museum Publications ISBN 0714120472. PMC 20756487. (Noiz kontsultatua: 2019-04-03).
- ↑ Aitken, M. J. (Martin Jim). ((1994 printing)). Science-based dating in archaeology. Longman ISBN 0582493099. PMC 19354722. (Noiz kontsultatua: 2019-04-03).
- ↑ a b «Fullerenes: An Overview» www.ch.ic.ac.uk (Noiz kontsultatua: 2019-04-03).
- ↑ Carbon nanotubes : preparation and properties. CRC Press 1997 ISBN 0849396026. PMC 34658728. (Noiz kontsultatua: 2019-04-03).
- ↑ Gasque, P.. El elemento con múltiples personalidades. .
- ↑ a b Shriver & Atkins' inorganic chemistry. (5th ed. argitaraldia) Oxford University Press 2010 ISBN 9780199236176. PMC 430678988. (Noiz kontsultatua: 2019-04-03).
- ↑ (Ingelesez) Frondel, Clifford; Marvin, Ursula B.. (1967-5). «Lonsdaleite, a Hexagonal Polymorph of Diamond» Nature 214 (5088): 587–589. doi:. ISSN 0028-0836. (Noiz kontsultatua: 2019-04-03).
- ↑ Carbon nanotubes : synthesis, structure, properties, and applications. Springer 2001 ISBN 3540410864. PMC 45093694. (Noiz kontsultatua: 2019-04-03).
- ↑ Hoover, Rachel. (2014-02-21). «Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That» NASA (Noiz kontsultatua: 2019-04-03).
- ↑ «ZT Hiztegi Berria» zthiztegia.elhuyar.eus (Noiz kontsultatua: 2019-04-03).
- ↑ (Ingelesez) Kroto, H. W.; Heath, J. R.; O'Brien, S. C.; Curl, R. F.; Smalley, R. E.. (1985-11). «C60: Buckminsterfullerene» Nature 318 (6042): 162–163. doi:. ISSN 0028-0836. (Noiz kontsultatua: 2019-04-03).
- ↑ Donaldson, K. (2001-03-01). «Ultrafine particles» Occupational and Environmental Medicine 58 (3): 211–216. doi:. PMID 11171936. PMC PMC1740105. (Noiz kontsultatua: 2019-04-03).