Hasarazle
Hasarazlea erreakzio kimiko bat abiarazten duen eta erreaktiboetako bat ez den substantzia edo molekula da. Kate-polimerizazioetan usatzen dira, besteak bete[1].
Hasarazleak beroaren bidez edo erradiazio ikusgarri zein ultramorearen bidez aktiba daitezke. Bigarren multzokoei fotohasarazle esaten zaie.
Hasarazleek normalean lotura ahulak dituzte, hots, loturaren disoziazio-energia txikia izaten da.
Hasarazle-motak[aldatu | aldatu iturburu kodea]
Hasarazlea mota batekoa ala bestekoa izango da kate-polimerizazioaren izaeraren arabera. Hortaz, erradikal-polimerizazioetan hasarazlea erradikalarioa izango da eta ioi-polimerizaioetan, ioinikoa, anioia zein katioia[2][3].
Hasarazle ioionikoak[aldatu | aldatu iturburu kodea]
Anioi-polimerizazioan usatzen diren hasarazleak izaera basikoa dute, hala nola, alkohoxidoak, metal hidroxidoak, fosfina edo metil litioaren moduko organometalikoak.
Katioi-polimerizazioan, aitzitik, protoia izaten da hasarazle ohikoena. Protoi horren iturria alkoholak, ura edo azido klorhidrikoa izan daitezke eta, normalen, alumino kloruroaren gisako Lewis azido batekin asoziatuta baliatzen dira.
Erradikal-hasarazleak[aldatu | aldatu iturburu kodea]
Haluroak[aldatu | aldatu iturburu kodea]
Haluroek nahikoa erraz pairatzen duten homolisia. Kloroak esaterako bi kloruro erradikal (Cl•) sortzen ditu argi ultramorearen eraginez. Alkanoak kloratzeko usatzen da.
Konposatu azoikoak[aldatu | aldatu iturburu kodea]
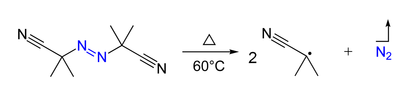
Konposatu azoikoak (R-N=N-R') bi erradikalen aitzindariak izan daiteke bai berotuz baita irradiatuz ere. Adibidez, azobisisobutironitriloak erreakzio hau pairatzen du:
Peroxido organikoak[aldatu | aldatu iturburu kodea]
Peroxido organikoek bi oxigenotan zentratutako bi erradikal ematen dituzte. Hauek ez-egonkorrak direnez egonkorrago diren bi karbonotan zentratutako erradikal bihurtzen dira. Adibidez, di-tert-butil peroxidoa bi tert-butoxi erradikal (t-BuO•) sortzen ditu, zeintzuk metil erradikal (CH3•) bihurtzen diren segidan azetona askatuz.
- (CH3)3COOC(CH3)3 → 2 (CH3)3CO•
- (CH3)3CO• → (CH3)2CO + CH3•
Peroxido ez-organikoak[aldatu | aldatu iturburu kodea]
Peroxido ez-organikoak organikoen moduan jokatzen dute. Adibidez, disoluzioan peroxidisulfatoa dizoziatu egiten da sulfato erradikalak formatuz. Estirenoa eta fluoroalkenoak polimerizatzeko baliatzen dira.
[O3SO–OSO3]2− ⇌ 2 [SO4]•−
Erreferentziak[aldatu | aldatu iturburu kodea]
- ↑ «ZT Hiztegi Berria» zthiztegia.elhuyar.eus (Noiz kontsultatua: 2021-03-19).
- ↑ Elortza, Josemari & Iruin, J. J.. (1988). Kimika fisikoko makromolekularra. Ibarsusi ISBN 84-86967-01-5. PMC 907326689. (Noiz kontsultatua: 2021-03-19).
- ↑ (Gaztelaniaz) Areizaga, Javier; Cortázar, M. Milagros; Elortza, Jose M. & Iruin, Juan J.. (2002). Polímeros. Editorial Síntesis, 44-50 or. ISBN 84-9756-026-4..

