Kloruro
| Kloruro | |
|---|---|
| Konposizioa | chloride ion (en) |
| Mota | Haluro |
| Identifikatzaileak | |
| Gmelin | 23114 |
| MeSH | D002712 |
Kloruro ioia /ˈklɔːraɪd/[1] anioia (negatiboki kargatutako ioia) Cl− da. Kloro elementuak (halogeno bat) elektroi bat irabazten duenean edo hidrogeno kloruroa bezalako konposatu bat uretan edo beste disolbatzaile polarretan disolbatzen denean sortzen da. Sodio kloruroa bezalako kloruro-gatzak, sarritan, oso disolbagarriak dira uretan[2]. Azido/base oreka mantentzeaz, nerbio-bulkadak transmititzeaz eta zeluletan sartu eta irteteko likido-fluxua erregulatzeaz arduratzen den gorputz-fluido guztietan kokatuta dagoen funtsezko elektrolitoa da. Gutxiagotan, kloruro hitzak kloro-atomo bat edo gehiago kobalenteki lotuta dauden konposatu kimikoen izen «ohikoren» parte izan daiteke. Adibidez, metil kloruroa, klorometano izen estandarra duena (ikus IUPAC liburuak), C-Cl lotura kobalentea duen konposatu organiko bat da, zeinetan kloroa ez den anioi bat.
Propietate elektronikoak[aldatu | aldatu iturburu kodea]
Kloruro-ioi bat (167 pm diametroa) kloro atomo bat baino askoz handiagoa da (99 pm diametroa). Hori kloruro anioiak kloro atomoak baino elektroi bat gehiago duelako da, nukleoaren atxikipena balentzia-oskolean murrizten duelako[3]. Ioia koloregabea eta diamagnetikoa da. Ur-disoluzioan, oso disolbagarria da kasu gehienetan; hala ere, gatz kloruro batzuentzat —esate baterako, zilar kloruroa, berun(II) kloruroa eta merkurioa(I) kloruroa—, uretan, apur bat disolbagarriak dira. Ur-disoluzioan, kloruroa ur molekulen mutur protikoarekin lotzen da.
Kloruroaren erreakzioak[aldatu | aldatu iturburu kodea]
Kloruroa oxidatu daiteke, baina ez murriztu. Lehenengo oxidazioa, kloro-alkali prozesuan erabiltzen den moduan, kloroa gas bihurtzea da. Kloroa beste oxido eta oxianioi batzuetara oxidatu daiteke, besteak beste, hipokloritoa (ClO-, klorozko lixibaren osagai aktiboa), kloro dioxidoa (ClO2), kloratoa (ClO−
3).eta perkloratoa (ClO−
4).
Bere azido-base propietateei dagokienez, kloruroa base ahula da, azido klorhidrikoaren pKa-ren balio negatiboak adierazten duen moduan. Kloruroa azido indartsuen bidez protonatu daiteke, hala nola azido sulfurikoaz:
- NaCl + H2 SO4 → NaHSO4 + HCl
Kloruro ionikoen gatzek beste gatz batzuekin erreakzioatzen dute anioiak trukatzeko. Kloruroa bezalako haluro ioien presentzia zilar nitratoa erabiliz antzeman daiteke. Kloruro ioiak dituen disoluzio batek zilarrezko kloruro hauspeatu zuri bat sortuko du[4]:
- Cl− + Ag + → AgCl
Saiakera batean, kloruroaren kontzentrazioa kloridometro baten bidez zehaztu daiteke, erreakzio horren bidez saiakuntzako kloruro guztia hauspeatu ondoren zilar ioiak detektatuko dituena.
Zilarrezko elektrodo klorurotuak ex vivo erabiltzen dira normalean elektrofisiologian[5].
Beste oxianio batzuk[aldatu | aldatu iturburu kodea]
Kloroak -1, +1, +3, +5 edo +7-ko oxidazio-egoerak har ditzake. Hainbat kloro oxido neutro ere ezagutzen dira.
Naturan duen agerpena[aldatu | aldatu iturburu kodea]
Naturan, kloruroa itsasoko uretan aurkitzen da, batez ere, eta 19.400 mg/litro kloruro ioien kontzentrazioa du. Kantitate txikiagoak, nahiz eta kontzentrazio handiagoan, barnealdeko zenbait itsasotan eta lurpeko gatzun putzuetan gertatzen dira: Utahko Great Salt Lake eta Israelgo Itsaso Hilean, adibidez. Kloruro-gatz gehienak uretan disolbagarriak dira; beraz, kloruroa duten mineralak klima lehorrean edo lurpeko sakonetan soilik aurkitzen dira. Kloruroa duten mineral batzuk: halita (sodio kloruroa NaCl), silvita (potasio kloruroa KCl), biskofitoa (MgCl2∙6H2O), karnalita (KCl∙MgCl2∙6H2O) eta kainita (KCl∙MgSO4-3H2O). Ebaporita mineraletan ere aurkitzen da, hala nola klorapatita eta sodalitan.
Biologian duen eginkizuna[aldatu | aldatu iturburu kodea]
Kloruroak garrantzi fisiologiko handia du, presio osmotikoaren erregulazioa, elektrolitoen oreka eta azido-base homeostasia barne hartzen dituena. Kloruroa gorputz-likido guztietan dago[6], eta zelulaz kanpoko anioirik ugariena da, zelulaz kanpoko likidoaren tonikotasunaren heren bat inguru hartzen baitu[7][8].
Kloruroa funtsezko elektrolitoa da, eta funtsezko eginkizuna du zelulen homeostasia mantentzeko eta neuronetan ekintza-potentzialak transmititzeko[9]. Kloruro-kanaletatik igaro daiteke (GABAA hartzailea barne) eta KCC2 eta NKCC2 garraiatzaileek garraiatzen dute.
Kloruroa, normalean (nahiz eta ez beti), zelulaz kanpoko kontzentrazio handiagoan egon ohi da, eta horrek alderantzikatzeko potentzial negatiboa izatea eragiten du (-61 mV inguru 37 °C-an ugaztun zelula batean)[10]. Organismo ereduetan kloruro-kontzentrazio bereizgarriak hauek dira: bai E. coli-n eta bai kimu-legamian 10-200 mM (medioaren araberakoa), 5-100 mM ugaztun-zeluletan eta 100 mM odol plasman[11].
Odolean dagoen kloruroaren kontzentrazioari, serum kloruro deitzen zaio, eta kontzentrazio hori giltzurrunek erregulatzen dute. Kloruro ioia proteina batzuen egitura-osagai bat da; adibidez, amilasa entziman dago. Eginkizun horietarako, kloruroa mineral dietetiko ezinbestekoetako bat da (kloro elementuaren izenaren arabera zerrendatua). Serum kloruroaren mailak giltzurrunek erregulatzen dituzte, batez ere, nefronean zehar dauden hainbat garraiatzaileen bidez[12]. Glomeruluaren bidez iragazten den kloruroaren zatirik handiena, hodi hurbilek zein urrunek (gehienetan hodi hurbilek) birxurgatzen dute garraio aktibo zein pasiboaren bidez[13].
Korrosioa[aldatu | aldatu iturburu kodea]

Kloruroen presentziak, hala nola itsasoko uretan, nabarmen okertzen ditu metal gehienen (altzairu herdoilgaitzak, aluminioa eta aleazio handiko materialak barne) pitting korrosioaren baldintzak. Hormigoiaren altzairuaren kloruroak eragindako korrosioa hormigoi alkalinoan oxidoaren babes-formaren tokian tokiko matxura dakar, eta, beraz, ondorengo korrosio-eraso lokalizatua gertatzen da.
Ingurumen-mehatxuak[aldatu | aldatu iturburu kodea]
Kloruro-kontzentrazio handitzeak hainbat eragin ekologiko eragin ditzake uretako zein lurreko inguruneetan. Errekak azidotzen lagun dezake; ioi-trukearen bidez, lurzoruko metal erradioaktiboak mobilizatzen ditu; uretako landareen eta animalien hilkortasunean eta ugalketan eragin dezake; ur gazietako organismoen inbasioa susta dezake lehenago ur gezako inguruneetan eta lakuen nahasketa naturala oztopatuz. Kontzentrazio nahiko baxuetan, sodio kloruroak mikrobio-espezieen konposizioa aldatzen duela ere frogatu da. Era berean, desnitrifikazio-prozesua oztopatu dezake nitratoak kentzeko eta uraren kalitatea kontserbatzeko ezinbestekoa den mikrobio-prozesua eta materia organikoaren nitrifikazioa eta arnasketa galaraziz.
Ekoizpena[aldatu | aldatu iturburu kodea]
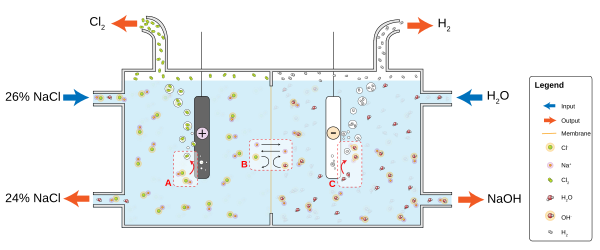
Klor-alkali industria munduko energia aurrekontuaren kontsumitzaile nagusia da. Prozesu horrek sodio kloruroa, hala, kloro eta sodio hidroxido bihurtzen du, eta beste hainbat material eta produktu kimiko egiteko erabiltzen dira. Prozesuak bi erreakzio paralelo ditu:
- 2 Cl− → Cl
2 + 2 e− - 2 H
2O + 2 e− → H2 + 2 OH−
Adibideak eta erabilerak[aldatu | aldatu iturburu kodea]
Adibide bat mahai-gatza da, NaCl formula kimikoa duen sodio kloruroa. Uretan, Na+ eta Cl− ioietan disoziatzen da. Kaltzio kloruroa, magnesio kloruroa, potasio kloruroa bezalako gatzak erabilera askotarikoak izan ditu tratamendu medikoetatik zementuaren eraketaraino[2].
Kaltzio kloruroa (CaCl2) geletatik hezetasuna kentzeko pellet moduan merkaturatzen den gatza da. Kaltzio kloruroa asfaltatu gabeko errepideak mantentzeko eta eraikuntza berrietarako bide-oinarriak sendotzeko ere erabiltzen da. Gainera, kaltzio kloruroa oso erabilia da desizozgarri gisa, izotza aplikatzen denean urtze-puntua jaisteko eraginkorra baita[14].
Lotura kobalenteko kloruroen adibideak fosforo trikloruroa, fosforo pentakloruroa eta tionil kloruroa dira, hirurak laborategi batean erabili diren klorazio erreaktiboak diren erreaktiboak.
Uraren kalitatea eta tratamendua[aldatu | aldatu iturburu kodea]
Kloruroaren aplikazio nagusi bat gatz desalinizazioa da, ura edangarria emateko kloruro-gatzak energia intentsiboa kentzea dakar. Petrolioaren industrian, kloruroak lokatz sistemaren osagai zorrotz kontrolatuak dira. Lokatz-sisteman, kloruroak areagotzea presio handiko ur gaziaren formazio bat zulatzearen adierazgarri izan daiteke. Bere igoerak helburuko harearen kalitate txarra ere adieraz dezake.
Kloruroa ibaiaren eta lurpeko uren kutsadura fekalaren adierazle kimiko erabilgarria eta fidagarria ere bada, kloruroa solutu ez-erreaktiboa baita eta ur zikinetan eta ur edangarrietan nonahi baitago. Mundu osoko ura erregulatzen duten enpresa askok kloruroa erabiltzen dute ibaien eta ur edangarriaren iturrien kutsadura maila egiaztatzeko[15].
Janariak[aldatu | aldatu iturburu kodea]
Kloruro-gatzak, esate baterako, sodio kloruroa elikagaiak kontserbatzeko eta mantenugai edo ongailu gisa erabiltzen dira.
Erreferentziak[aldatu | aldatu iturburu kodea]
- ↑ Wells, John C. (2008), Longman Pronunciation Dictionary (3rd ed.), Longman, p. 143, ISBN 9781405881180
- ↑ a b Green, John, and Sadru Damji.
- ↑ «Size of Atoms» chemed.chem.purdue.edu.
- ↑ (Ingelesez) «Testing for halide ions - Group 0 and testing ions - GCSE Chemistry (Single Science) Revision - WJEC» BBC Bitesize.
- ↑ Molleman, Areles (2003).
- ↑ (Ingelesez) Deane, Norman; Ziff, Morris; Smith, Homer W.. (1952). «The distribution of total body chloride in man» Journal of Clinical Investigation 31 (2) doi:. OCLC .436401 PMID 14907900..
- ↑ Berend, Kenrick; van Hulsteijn, Leonard Hendrik; Gans, Rijk O.B.. (April 2012). «Chloride: The queen of electrolytes?» European Journal of Internal Medicine 23 (3): 203–211. doi:. PMID 22385875..
- ↑ Rein, Joshua L.; Coca, Steven G.. (1 March 2019). «"I don't get no respect": the role of chloride in acute kidney injury» American Journal of Physiology. Renal Physiology 316 (3): F587–F605. doi:. ISSN 1931-857X. OCLC .6459301 PMID 30539650..
- ↑ Jentsch, Thomas J.; Stein, Valentin; Weinreich, Frank; Zdebik, Anselm A.. (2002-04-01). «Molecular Structure and Physiological Function of Chloride Channels» Physiological Reviews 82 (2): 503–568. doi:. ISSN 0031-9333. PMID 11917096..
- ↑ «Equilibrium potentials» www.d.umn.edu.
- ↑ Milo, Ron; Philips, Rob. «Cell Biology by the Numbers: What are the concentrations of different ions in cells?» book.bionumbers.org.
- ↑ (Ingelesez) Nagami, Glenn T.. (1 July 2016). «Hyperchloremia – Why and how» Nefrología (English Edition) 36 (4): 347–353. doi:. ISSN 2013-2514. PMID 27267918..
- ↑ Shrimanker, Isha; Bhattarai, Sandeep. (2020). Electrolytes. StatPearls Publishing PMID 31082167..
- ↑ «Common Salts» hyperphysics.phy-astr.gsu.edu (Georgia State University).
- ↑ «Chlorides» www.gopetsamerica.com.
Ikus, gainera[aldatu | aldatu iturburu kodea]
- Halogenoak (halogenoen konposatuak)
