Organosufre-konposatu

Organosufre-konposatuak karbono atomoei lotuta dauden sufre atomoak dituzten konposatu organikoak dira. Askotan, usain txarrekin lotzen dira, baina ezagutzen diren konposatu gozoenetako asko sufre organoen deribatuak dira. Natura organosufre-konposatuetan aberatsa da, sufrea ezinbestekoa baita bizitzarako. Hogei aminoazido arruntetatik, bi organosufre-konposatuak dira. Erregai fosilek, ikatza, petrolioa eta gas naturala, antzinako izaki bizidunen materialen eratorriak direnez, nahitaez organosulfre-konposatuak dituzte, eta petrolio findegien helburu nagusia da horiek kentzea.
Sufrea taula periodikoaren 16. taldekoa da (anfigenoak edo kalkogenoak), oxigenoarekin batera, eta organosufre-konposatuek karbono-oxigeno loturak dituzten konposatuekin antzekotasunak izatea espero da, eta hori, neurri batean, egia da.
Sufrea duten konposatu organikoak detektatzeko, Carius metodoa da analisi kimiko klasiko bat.
Organosufre-konposatuen klaseak[aldatu | aldatu iturburu kodea]
| Organosufre-konposatuen klaseak | Adibideak | |||
|---|---|---|---|---|
| Formula orokorra | Grupo de sustancias | Oxidazio zenbakia | Egiturazko formula | Izena |
| R–SH | Alkanotiolak[1] | −II | Etanotiol[1] | |
| Ar–SH | Tiofenol[1] | −II | 
|
Tiofenol[1] |
| R–S–R' | Sulfuro (o Tioeter)[2] | −II | Etilmetilsulfuro | |
| R–S–S–R' | Disulfuroak[3] | −I | 
|
4,4'-Dinitrodifenildisulfuro |
| R–SO–OH | Azido sulfiniko[4] | +II | 
|
Azido etanosulfiniko |
| R–SOO–OH | Azido sulfoniko[5] | +IV | 
|
Azido propanosulfoniko |
| R–SOO–X | Azido sulfonikoaren deribatua[6][7] | +IV | 
|
Bentzenosulfonilo kloruroa[8] |
| R–SO–R' | Sulfoxido[9] | 0 | 
|
Dimetilsulfoxido[10] |
| R–SOO–R' | Sulfona[10] | +II | 
|
Dietilsulfona |
| R–S–OH | Azido sulfeniko[11] | 0 | Azido etanosulfeniko | |
| R–O–SO3H | Alkilsulfato[12] | +VI | 
|
Etanilsulfato |
| R–O–SO2–O–R' | Dialkilsulfato | +VI | 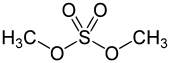
|
Dimetilsulfato[13] |
| R2N–CS–R'2 | Tioureak[14] | 
|
Tiourea[14] | |
Sufre-atomoa duen talde funtzionalaren arabera sailkatzen dira konposatu organosulfurikoak, taulan adierazten den moduan. Gertaldian beheranzko hurrenkeran agertzen dira.
- Sufre organoen konposatuen adibide batzuk
-
Alizina, baratxuriaren osagai aktiboa
-
R- zisteina, tiol taldea duen aminoazidoa
-
Metionina, tioeter talde bat duen aminoazidoa
-
Difenilo disulfuroa, disulfuro adierazgarria
-
Dibenzotiofenoa, petrolioaren osagaia
-
Azido perfluorooktanosulfonikoa, surfaktant polemikoa
Tioeterrak, tioesterrak, tioazetalak[aldatu | aldatu iturburu kodea]
Konposatu horiek C-S-C loturak edukitzea dute ezaugarri[15][16]. C-C loturekin alderatuta, C-S loturak luzeagoak dira, S atomoa karbono atomoa baino handiagoa baita, eta % 10 ahulagoa. Sufre-konposatuetan lotura-luzera tipikoak 183 pm-koak dira S-C metanotiol-en loturarako eta 173 pm tiofenoan. C-S loturaren disoziazio-energia 89 kcal/mol (370 kJ/mol) da tiometanoarentzat metanoaren 100 kcal/mol-ekin (420 kJ/mol) alderatuta, eta hidrogenoa, metil talde batekin ordezkatzen denean, energia 73 kcal/mol-etan (305 kJ/mol) murrizten da[17]. Karbono-oxigeno lotura sinpleak C-C loturak baino lotura luzera laburragoa du. Dimetil sulfuroaren eta dimetileterren loturaren disoziazio-energiak 73 eta 77 kcal/mol dira (305 eta 322 kJ/mol, hurrenez hurren).
Tioeterrak tiolen alkilazioaren bidez prestatu ohi dira. Pummerer berrantolaketa baten bidez ere prestatu daitezke. Ferrario erreakzioa deritzon erreakzioan; sufre elementalaren eta aluminio kloruroaren bidez, fenileterra fenoxathione bihurtzen da[18].
Tioazetalek eta tiozetalek C-S-C-S-C lotura-sekuentzia bereizgarria erakusten dute. Tioeterren azpiklase bat adierazten dute. Tioazetalak karbonilo taldeen umpolungean (erreaktibitatearen itzulera) erabilgarriak dira.
Tioesterrek R-CO-SR egitura orokorra dute. Ester erregularrekin erlazionatuta daude, baina erreaktiboagoak dira.
Tiofenoek aromatikoak diren tioeter klase berezi bat adierazten dute. Tiofenoaren erresonantzia-egonkortzea 29 kcal/mol (121 kJ/mol) da oxigeno atomoen analogikorako (furanoak) diren 20 kcal/mol-ekin (84 kJ/mol) alderatuta. Ezberdintasun horren arrazoia oxigenoaren elektronegatibitate handiagoa da, eta horrek elektroiak beregana desplazatzen ditu eraztun aromatikoaren kontura. Hala ere, ordezkatzaile aromatiko gisa, tio taldeak, talde aktibazio gisa, alkoxi taldeak baino eraginkortasun txikiagoa du.
Tiolak, disulfuroak, polisulfuroak[aldatu | aldatu iturburu kodea]
Tiolek R-SH talde funtzionala dute. Tiolak alkoholen antzekoak dira, egituraz, baina funtzio horiek oso desberdinak dira propietate kimikoetan. Tiolak nukleofiloagoak, azidoagoak dira, eta errazago oxidatzen dira. Azidotasun hori 5 pKa unitate ingurutan alda daiteke[19].
Sufrearen (2,58) eta hidrogenoaren (2,20) arteko elektronegatibitate-aldea txikia da, eta, beraz, tioletan, hidrogeno-lotura ez da esanguratsua. Tiol alifatikoek urrezko monogeruzak eratzen dituzte, egun nanoteknologian garrantzitsuak direnak.
Herz erreakzio baten bidez, zenbait tiol aromatiko lor daitezke.
R-S-S-R lotura disulfuroa sufre-sufre lotura kobalentearekin gurutzatzeko garrantzitsua da: biokimikan, proteina batzuen tolesterako eta egonkortasunerako, eta, polimeroen kimikan, kautxua gurutzatzeko.
Sufre-atomoen kate luzeagoak ere ezagutzen dira, barazina produktu naturalean bezala, zeinak ezohiko pentatiepinea eraztun bat daukan (bentzeno-eraztun baten ondoko bi karbono-atomotan ziklatutako 5 sufre-atomoko katea).
Tiozetonak, tioaldehidoak eta erlazionatutako konposatuak[aldatu | aldatu iturburu kodea]
Karbonoaren eta sufrearen arteko lotura bikoitza duten konposatuak (C=S) nahiko arraroak dira, baina konposatu garrantzitsuak dira karbono disulfuroa, karbonilo sulfuroa eta tiofosgenoa. Tiozetonak (RC(=S)R' arraroak dira alkilo-ordezkatzaileekin, baina adibide bat tiobenzofenona da. Tioaldehidoak are arraroagoak dira, babes esterikorik eza islatuz (tioformaldehidoa trimero zikliko gisa dago). Tioamidak, R1C(=S)N(R2)R3 formulakoak, ohikoagoak dira. Normalean, amiden erreakzioengatik, Lawessonen erreaktiboarekin erreakzionatuz prestatzen dira.
C=S lotura bikoitzak dituzten konposatuak sulfonio iluroan daude, adibidez Johnson-Corey-Chaykovsky erreakzioan.
Karbonoaren eta sufrearen arteko lotura hirukoitza[aldatu | aldatu iturburu kodea]
Sufrearen eta karbonoaren arteko lotura hirukoitzak arraroak dira sulfaalkinoetan, eta karbono monosulfuroan (CS)[20] aurki daitezke, eta F3CCSF3[21][22] eta F5SCSF3 konposatuetarako iradoki dira[23]. HCSOH konposatua lotura hirukoitz formala duela ere agertzen da[24].
Azido tiokarboxilikoak eta tioamidak[aldatu | aldatu iturburu kodea]
Azido tiokarboxilikoak (RC(O)SH) eta azido ditiokarboxilikoak (RC(S)SH) ezagunak dira. Egituraz, azido karboxilikoen antzekoak dira, baina azidotasun handiagoa dute. Tioamidak amideen antzekoak dira.
Azido sulfonikoak, esterrak, amidak[aldatu | aldatu iturburu kodea]
Azido sulfonikoek RS(=O)2OH talde funtzionala dute[25]. Disolbatzaile organikoetan, normalean, disolbagarriak diren azido sendoak dira. Azido sulfonikoak, hala nola azido trifluorometanosulfonikoa, maiz erabiltzen dira kimika organikoan. Sulfonamidak, sulfonazio aromatiko bidez eratorritako sulfonamidak dira.
Sulfuranoak eta Persulfuranoak[aldatu | aldatu iturburu kodea]
Sulfuranoak talde funtzional nahiko espezializatua dira, tetrabalenteak direlako; beraz, sufre-konposatu hiperbalenteak dira[26], SR4 formula dutenak, eta, era berean, SR6 formula duten persulfuranoak hexabalenteak dira. Persulfuranoak, ordezkatzaile organiko guztiekin, kalkogeno taldeko konposatu astunenak direla jakin izan da; adibidez, hexametilpertelurano (Te(Me)6) konposatu analogoa 1990ean aurkitu zen[27] tetrametiltelurioren erreakzioa xenoiaren difluoruroarekin Te(Me)2)F2 eta dietilzinkaren erreakzioarekin jarraituz. Sufre-analogoa, hexametilpersulfurano SMe6, egonkorra izango dela aurreikusten da[28], baina oraindik ez da sintetizatu[29].
Ordezkatzaile organiko guztiekin, laborategi batean sintetizatu zen lehen persulfuranoak bi estekatzaile metil eta bi bifenilo ditu[30]:

Dagokion sulfuranotik prestatzen da 1 xenoi difluoruroarekin / boro trifluoruro azetonitriloan dikation sulfuranilo emateko 2 jarraituz metillitioaren erreakzioarekin tetrahidrofuranoan persulfurano (egonkorra) 3 cis isomero gisa emateko. X izpien difrakzioak erakusten du C - S loturaren luzera 189 eta 193 pm bitartekoa dela (loturaren luzera estandarra baino luzeagoa) sufrearen atomo zentrala geometria molekular oktaedriko distortsionatu batez
In silico esperimentuek iradokitzen dute lotura horiek oso polarrak direla karbonoarekiko karga negatibo partzialekin.
Organosulfre-konposatu naturalak[aldatu | aldatu iturburu kodea]
Sufre organoko konposatu guztiak ez dira usain txarra duten kutsatzaileak. Alizina eta ajoenea bezalako konposatuak dira baratxuri usainaren erantzule, eta lentioninak shiitake perretxikoen zaporea laguntzen du. Produktu natural horietako askok propietate sendagarri garrantzitsuak dituzte, esate baterako, plaketen agregazioa prebenitzea edo minbiziaren aurka borrokatzea.
Organosulfre-konposatuak kutsaduran[aldatu | aldatu iturburu kodea]
Ingurumenean dauden sufre-konposatu organiko gehienak jatorri naturalekoak dira, sufrea bizitzarako ezinbestekoa dela eta bi aminoazidok elementu hori daukatenaren ondorioz.
Ingurumenean dauden organosufre-konposatu batzuk industria-prozesuen azpiproduktu txiki gisa sortzen dira, hala nola plastikoak eta pneumatikoen fabrikazioa.
Zenbait prozesuk organo sufre-konposatuak ekoizten dituzte —adibidez, ikatzetik kokearen fabrikazioan— sufre-konposatuak eta beste ezpurutasun lurrunkor batzuk kanporatzeko eta horrela «ikatz garbia» (kokea) ekoizteko, batez ere, altzairua ekoizteko erabiltzen dena. .
Erregai fosiletako organosufre-konposatuak[aldatu | aldatu iturburu kodea]
Usain txarra duten substantziak ikatza edo petrolio gordina prozesatzeko prozesu kimikoetan ere ekoizten dira, eta, horietan, aitzindari kimikoak (lehengaiak) lortzen dira gero industria-erabilerarako (adibidez, plastikoak egiteko edo farmazia-ekoizpenean), eta leku guztietan petrolioaren destilazioaren beharrak (gasolina, gasolioa eta beste erregai batzuk) lortzeko.
Organosulfre-konposatuak usain txarreko kutsatzaile gisa ikus daitezke erabilera komertziala baino lehen gas naturaletik, ihes-gasetatik eta fabrika-kebideetatik atera aurretik kendu behar direnak. Azken testuinguru horretan, organosufre-konposatuak euri azidoko sufre-kutsatzaileen parte dira; baita erregai fosil ohikoenetako kutsatzaileen parte dira, batez ere ikatza .
Erreferentziak[aldatu | aldatu iturburu kodea]
- ↑ a b c d Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 473−476, [[:es:Especial:FuentesDeLibros/3342002808|ISBN 3-342-00280-8.]]
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 477−479, ISBN 3-342-00280-8
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 144, ISBN 3-7776-0406-2
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 480−481, ISBN 3-342-00280-8
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 480−487, ISBN 3-342-00280-8
- ↑ Ácidos sulfónicos y sus derivados. En: Tratado de química orgánica. F. Klages. Editorial Reverté. [[:es:Especial:FuentesDeLibros/8429173153|ISBN 8429173153]]. Pág. 763
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 484−485, ISBN 3-342-00280-8
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 485, ISBN 3-342-00280-8
- ↑ Siegfried Hauptmann3: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 479−480, ISBN 3-342-00280-8
- ↑ a b Hauptmann, p.3
- ↑ Siegfried Hauptmann9: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 485, ISBN 3-342-00280-8
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 235−236, [[:es:Especial:FuentesDeLibros/3777604062|ISBN 3-7776-0406-2]].
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 137, ISBN 3-7776-0406-2
- ↑ a b Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, S. 471−472, ISBN 3-342-00280-8
- ↑ Organic chemistry IUPAC Blue Book. Rules C-5: Compounds Containing Bivalent Sulfur http://www.acdlabs.com/iupac/nomenclature/79/r79_25.htm
- ↑ Organic chemistry IUPAC Blue Book. Recommendation R-5.7.1.3.4 Thiocarboxylic and thiocarbonic [Esteka hautsia]
- ↑ Handbook of Chemistry and Physics, 81st Edition CRC Press ISBN 0-8493-0481-4
- ↑ Organic Syntheses, Coll. Vol. 2, p.485 (1943); Vol. 18, p.64 (1938). Enlace
- ↑ R. J. Cremlyn “An Introduction to Organosulfur Chemistry” John Wiley and Sons: Chichester (1996). ISBN 0 471 95512 4.
- ↑ doi:10.1021/cr00084a003
- ↑ [Nomenclature Rules C-5: Compounds Containing Bivalent Sulfur]doi:10.1002/anie.198401501
- ↑ doi:10.1021/ja00050a027
- ↑ doi:10.1002/anie.198815341
- ↑ doi:10.1002/anie.200903969
- ↑ Organic chemistry IUPAC Blue Book.C-6 Sulfur Halides, Sulfoxides, Sulfones, and Sulfur Acids and Their Derivatives http://www.acdlabs.com/iupac/nomenclature/79/r79_26.htm
- ↑ El azufre habitualmente es divalente. Fundamentos de tecnología química. V Hopp. Editorial Reverté, 1984. ISBN 8429172459. Pág.18
- ↑ Synthesis and characterization of hexamethyltellurium(VI) Latif Ahmed, John A. Morrison J. Am. Chem. Soc.; 1990; 112(20); 7411-7413. Abstract
- ↑ The S6 Point Group Conformers of the Hexamethylchalcogens: Me6S, Me6Se, Me6Te Fowler, J. E.; Schaefer, H. F., III; Raymond, K. N. Inorg. Chem.; (Article); 1996; 35(2); 279-281. doi:10.1021/ic940240d
- ↑ he S6 Point Group Conformers of the Hexamethylchalcogens: Me6S, Me6Se, Me6Te Fowler, J. E.; Schaefer, H. F., III; Raymond, K. N. Inorg. Chem.; (Article); 1996; 35(2); 279-281. doi 10.1021/ic940240d 10.1021/ic940240d
- ↑ Isolation and Molecular Structure of the Organo-persulfuranes [12-S-6(C6)] Sato, S.; Matsunaga, K.; Horn, E.; Furukawa, N.; Nabeshima, T. J. Am. Chem. Soc.; (Communication); 2006; 128(21); 6778-6779. doi 10.1021/ja060497y
Kanpo estekak[aldatu | aldatu iturburu kodea]
- Organosulfuroaren kimika http://users.ox.ac.uk esteka . (ingelesez)
Karbonoaren lotura kimikoak beste atomoekin
| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Oinarrizko kimika organikoa. | Erabilera asko kimikan. |
| ikerketa akademikoa, baina ez oso erabilia. |
Lotura ezezaguna / Baloratu gabea. |





