Sodio kloruro
| Sodio kloruro | |
|---|---|
 | |
| Formula kimikoa | NaCl |
| SMILES kanonikoa | [Na+.[Cl-]&zoom=2.0&annotate=none 2D eredua] |
| MolView | [Na+.[Cl-] 3D eredua] |
| Konposizioa | sodio, kloro, sodio ioi eta chloride ion (en) |
| Mota | gatz eta kloruro |
| Ezaugarriak | |
| Dentsitatea | 2,165 g/cm³ |
| Errefrakzio indiziea | 1,544202 |
| Disolbagarritasuna | 360 g/kg (ur, 25 °C) |
| Momentu dipolarra | 9,001 D |
| Fusio-puntua | 800,8 °C 800,7 °C |
| Irakite-puntua | 1.413 °C 1.465 °C (101,325 kPa) |
| Entropia molar estandarra | 72,1 J/(mol K) |
| Fusio-entalpia | 9,001 D |
| Formazio entalpia estandarra | −234,8 kJ/mol |
| Masa molekularra | 57,959 Da |
| Erabilera | |
| Tratatzen du | deshidratazio, begi lehorren sindrome, corneal edema (en) |
| Kristalografia | |
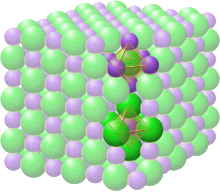
| Sistema kristalinoa | kristal-sistema kubiko |
| Talde espaziala | space group Fm-3m (en) |
| Arriskuak | |
| NFPA 704 | |
| GHS arriskua | baliorik ez |
| Arrisku motak | baliorik ez |
| Prekauzio motak | baliorik ez |
| Identifikatzaileak | |
| InChlKey | FAPWRFPIFSIZLT-UHFFFAOYSA-M |
| CAS zenbakia | 7647-14-5 |
| ChemSpider | 5044 |
| PubChem | 5234 |
| Reaxys | 3534976 |
| Gmelin | 26710 |
| ChEBI | 13673 |
| ChEMBL | CHEMBL1200574 |
| RTECS zenbakia | VZ4725000 |
| ZVG | 1330 |
| DSSTox zenbakia | VZ4725000 |
| EC zenbakia | 231-598-3 |
| ECHA | 100.028.726 |
| CosIng | 37813 |
| MeSH | D012965 |
| RxNorm | 9863 |
| Human Metabolome Database | HMDB0303410 |
| UNII | 451W47IQ8X |
| NDF-RT | N0000145832 |
| KEGG | C13563 eta D02056 |
- Artikulu hau elikagaiari buruzkoa da; beste esanahietarako, ikus «Gatz».
Sodio kloruroa edo gatz arrunta NaCl formula duen konposatu kimikoa da. Naturan halita mineral gisa edo hainbat disoluziotan agertzen da, itsasoan kasu. Halaber, itsasoaren gazitasunaren eragile nagusia da eta hainbat organismoren jariakin extrazelularra da. Orokorrean jaki edo kontserbante bezala erabiltzen da.
Beste nomenklatura kimikoak[aldatu | aldatu iturburu kodea]
NaCl era ezberdinetan izenda daiteke, nomenklatura kimikoaren arabera. Nomenklatura sistematikoan sodio monokloruro izango litzateke, Stock-en nomenklaturan sodio (I) kloruroa eta nomenklatura tradizionalean sodio kloruro edo kloruro sodikoa. Era berean, izen arruntak ere baditu, gatza edo gatz arrunta kasu.
Lorpena[aldatu | aldatu iturburu kodea]

Gatz arrunta lortzea ez da batere zaila edo garestia, orokorrean gatzagatan egiten da, ur gaziak desbideratzen. Itsasoko ur edo beste motatakoa sodio klorurodun urak desbideratzen dira eta plataforma edo lur eremu itxietara eramaten da, metro inguruko sakontasuneko aintziratxoak sortuz. Ura lurruntzean, sodio kloruroa prezipitatu egiten da, eta gero jaso. Ondoren tratamendu ezberdinak ematen zaizkio, kontsumorako gai izan dadin.
Eraginak[aldatu | aldatu iturburu kodea]
Kantitate handietan hartzean oso toxikoa izan daiteke bai animalia bai landareentzat. Zelulen lisia ekar dezake. Kantitate normaletan hartzean denbora luzean iraitz sisteman arazoak ekarriko luke.
Ukipenari begira, larruazala sumindu daiteke, baita begiak ere. Era berean, inhalazioak sudur konduktuen narritadura larria ekar dezake kantitatean handiak badira.
Propietate fisiko-kimikoak[aldatu | aldatu iturburu kodea]
Propietate fisikoak[aldatu | aldatu iturburu kodea]
- Agregazio egoera giro tenperaturan: Solidoa.
- Itxura: Koloregabea; hala ere zuria edo zurixka agertu daiteke kristalak final baldin badira.
- Dentsitatea: 2200 kg/m3; 2,2 g/cm3.
- Masa: 58,4 u.
- Fusio puntua: 1.074 K (801 °C)
- Irakite puntua: 1.738 K (1.465 °C)
- Egitura kristalinoa: Kristal kubikoak
Propietate Kimikoak[aldatu | aldatu iturburu kodea]
- Uretan disolbagarritasuna: 35,9g/100 mL ur
- KPS: 37,79 mol2
- Erlazionatutako konposatuak: Potasio kloruroa (KCl)
Termokimika[aldatu | aldatu iturburu kodea]
- ΔfH0gas: -181,42 kJ/mol
- ΔfH0likido: -385,92 kJ/mol
- ΔfH0solido: -411,12 kJ/mol
- S0gas, 1 bar: 229,79 J·mol-1·K-1
- S0likido, 1 bar: 385,06 J·mol-1·K-1
- S0solido: 72,11 J·mol-1·K-1
Erreferentziak[aldatu | aldatu iturburu kodea]
Ikus, gainera[aldatu | aldatu iturburu kodea]
- Gatz arrunt (Sodio kloruroaren ikuspuntu kulturala, ez kimikoa)

