Sodio
| Sodioa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 Neona ← Sodioa → Magnesioa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ezaugarri orokorrak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izena, ikurra, zenbakia | Sodioa, Na, 11 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie kimikoa | Metal alkalinoak | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Taldea, periodoa, orbitala | 1, 3, s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomikoa | 22,9897(2) g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
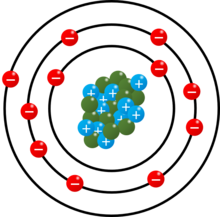
| Konfigurazio elektronikoa | Ne 3s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroiak orbitaleko | 2, 8, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate fisikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egoera | solido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dentsitatea | (0 °C, 101,325 kPa) 0.968 g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Urtze-puntua | 370,87 K (97,72 °C, 207,9 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Irakite-puntua | 1.156 K (883 °C, 1.621 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Urtze-entalpia | 2,60 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bero espezifikoa | (25 °C) 97,42 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lurrun-presioa
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate atomikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristal-egitura | kubikoa, aurpegietan zentratua | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidazio-zenbakia(k) | 1 (oxido basiko sendoa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatibotasuna | 0,93 (Paulingen eskala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizazio-potentziala | 1.a: 495,8 kJ/mol 2.a: 4.562 kJ/mol 3.a: 6.910,3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio atomikoa (batezbestekoa) | 180 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio atomikoa (kalkulatua) | 190 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio kobalentea | 154 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsen erradioa | 227 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopo egonkorrenak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sodioaren isotopoak
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sodioa Na (Latinetik natrium) sinboloa duen elementu kimikoa da. Haren zenbaki atomikoa 11 da eta metal alkalinoa da, taula periodikoaren 1. taldean eta 3. periodoan kokatuta. Elementu bigun, zuri zilarkara eta oso erreaktiboa da; izan ere, bere azken geruzan elektroi bakar bat dauka eta oso erraz askatu dezake Na+ katioia eratzeko. Isotopo egonkor bakarra dauka, 23Na. Lurrean aurkitu daitekeen 6. elementu ugariena da, eta aipatu bezala oso erreaktiboa da (potasioa baino gutxiago baina litioa baino gehiago): airearekin kontaktuan berehala oxidatzen da eta uretan oso erreaktiboa da. Ondorioz, naturan ezin daiteke bere egoera metalikoan aurkitu, batez ere konposatu ioniko moduan aurkezten delarik (feldespatoak, sodalitak, gatzetan…).
Ezaugarri nagusiak[aldatu | aldatu iturburu kodea]

Sodioa tenperatura eta presio estandarretan airetan oxigenoarekin konbinatzen da, sodio oxido grisa-zurixka eratuz. Sodio metala mozteko erraza da, eta elektrizitatearen beroaren eroale ona da; haren balentzia geruzan elektroi bakarra du, lotura metaliko ahulak sortuz, elektroien mugimendu askea posiblea izanik.
Masa atomiko txikia eta erradio atomiko handia izateagatik, sodioa metalen artean dentsitate (0,96 g/cm3) txikienetarikoa duena da, uretan flotatzeko ahalmena izanik. Fusio (98 °C) eta irakite (883 °C) tenperaturak litioarenak baino baxuagoak dira, baina gainontzeko metal alkalinoenak baino altuagoak, taldean aurrera egitean tenperaturak jaisten baitira.[1] Hala ere, propietate hauek asko aldatzen dira presio altuetan: 1,5 mbar-etan metalaren kolorea zilarreztatutik beltza izatera pasatzen da; 1,9 mbar-etan, materiala gardena bihurtzen da, gorri kolorearekin; eta, 3 mbar-eko presioan, sodioa solido kolorge eta gardena da.

Sodioaren garra azterketan, su garra horia askatzen da. Izan ere, 3s elektroiek fotoi bat igortzen dute 3p orbitaletik 3s orbitalera igarotzen direnean; fotoi honen uhin-luzera 589,3 nm-koa da (argi ikuskor horia). [2]
Isotopoak[aldatu | aldatu iturburu kodea]
Sodioaren hogei isotopo ezagutzen dira, 23Na isotopo egonkor bakarra izanik. 23Na bi karbono atomoen fusioaren ondorioz sortzen da, izarretan gertatzen den karbonoaren errekuntzan. Prozesu honek, 600 megakelvin baino tenperatura altuagoak behar ditu, eta izarrak gutxienez gure eguzkia baino 3 bider masa handiagoa izan behar du. [3] Honez gain beste bi isotopo garrantzitsu daude, 22Na- a, zein 2.6 urteko erdi-bizitza duen eta 24Na, zeinak 15 orduko erdi bizitza dauka. Ezagutzen diren beste isotopo guztiak minutu bat baino gutxiagoko erdi-bizitza daukate.
Askotan istripu nuklear kritikoetan askatutako neutroien erradiazioa odolean dauden 23Na atomo egonkorrak 24Na isotopo ez-egonkor bihurtu ditzake. Hau jakinda erradiazioa jasan duen biktima batean neutroien erradiazio kantitatea kalkula daiteke 24Na isotopoen kontzentrazioa erlatiboa 23Na-rekin konparatuz.
Propietate kimikoak[aldatu | aldatu iturburu kodea]
Sodio atomoak [Ne] 3s1 konfigurazio elektronikoa du, neon gas idealaren konfigurazio egonkorrenak baino elektroi bat gehiago. Halaber, lehen ionizazio energiaren balioa baxua da, 495,8 kJ/mol. Horregatik, sodioak balentzia-geruzan duen azken elektroia galtzeko joera handia dauka, Na+ karga positibodun katioia eratuz. Prozesu honek oso energia gutxi behar du gertatzeko, Na+ oso konfigurazio egonkorra lortzen duelako. Aldiz, bigarren elektroi bat galtzea askoz zailagoa da, bigarren ionizazio energiaren balioa oso altua baita, 4562 kJ/mol. Ondorioz, sodioak normalean Na+ katioiaz konposatu ionikoak eratzen ditu.
Beraz, sodioaren oxidazio egoera arruntena +1 da. Sodio metala erreduzitzaile sendoa da, Na+/Na bikotearen erredukzio-potentzial estandarraren balioa -2,71 V izanik. Hala ere, potasioak eta litioak potentzial negatiboagoak dituzte, sodioa baino erreduzitzaile sendoagoak izanik.


Gatz eta oxidoak[aldatu | aldatu iturburu kodea]
Sodioak hamaika gatz eta oxido mota eratzen ditu, elementu honek eratzen dituen konposatu garrantzitsuenak izanik. Izan ere, beiragintza, papergintza eta ehungintza bezalako industrietan garrantzi komertzial izugarria daukate. Sodioak eratzen dituen gatz garrantzitsuenak sodio kloruroa (NaCl), sodio karbonatoa (Na2CO3), sodio hidrogenokarbonatoa (NaHCO3), sodio hidroxidoa (NaOH), sodio nitratoa (NaNO3), sodio tiosulfatoa (Na2S2O3*5H2O) eta boraxa (Na2B4O7*10H2O) dira. Konposatuetan, sodioa normalean lotura ionikoen bidez lotzen da urarekin eta anioiekin, eta Lewis azido gogorra da.
Disoluzio akuosoak[aldatu | aldatu iturburu kodea]
Sodioaren gatzak solugarriak izaten dira; hala nola, halogenuroak, sulfatoak, nitratoak, kaboxilatoak eta karbonatoak. Hala ere, uretan ematen diren espezieak konplexu akuosoak izan ohi dira; hala nola, [Na(H2O)n]+. Ez da ohikoa hauspeatze zuzena ematea sodio gatzekin; izan ere, urarekiko afinitate handia izan ohi dute. Horregatik, sodio gatzak solido moduan isolatu ohi dira disolbatzaile organikoen bidez, etanola adibidez. Sodio kontzentrazio baxuenak absortzio atomikoko espektrometriaren (AA) bitartez edota ioi elektrodo selektiboaren potentziometria tekniken bidez determina daitezke.
Koordinazio konposatuak[aldatu | aldatu iturburu kodea]

Beste metal alkalinoak bezala, sodioa amoniako eta zenbait aminetan disolbatzen da disoluzio koloretsuak emateko; ondoren baporizazioa ematean sodioaren kristal disdiratsuak emanez. Disoluzioak koordinazio konplexu bitxiak eratzen dituzte, hala nola, [Na(NH3)6]+. Horrez gain, beste konposatu batzuekin ere era ditzake beste zenbait konplexu berezi; hala nola, eterrekin, kriptanoekin eta beste ligando batzuekin ere.
Konposatu organometalikoak[aldatu | aldatu iturburu kodea]
Sodio eta karbonoren arteko lotura polartasun handiko lotura izanik, karbanioien (gatzak + anioi organikoak) iturritzat erabili ahal dira. Sodioak duen tamainu handiagatik baita polartasun txikiarengatik, anioi erradikal handiak, aromatikoak eta polarizagarritasunak egonkortu ditzake; adibidez sodio naftalenuroaren kasuan, erreduzitzaile ona dena.
Konposatu intermetalikoak[aldatu | aldatu iturburu kodea]
Sodioak metal askorekin sor ditzake aleazio desberdinak; hala nola, potasio, kaltzio, berun eta 11. eta 12. taldeko elementuekin. Potasioarekin sortutako aleazioa likidoa da ingurune tenperaturan eta eroale termiko ona da. KNa2 eta NaK era ditzake. Kaltzioa ez da oso solugarria sodioan, soilik egoera likidoan daudenean.
Berunarekin aleazio ugari sor daitezke, eta metodo desberdinak daude horretarako; hala nola; biak batera urtzea edota sodioa elektrilitikoki berun katodo batean jartzea. Hauez gain, urrearekin (NaAu2) eta zilarrarekin (NaAg2) ere aleazioak posible dira.
Historia[aldatu | aldatu iturburu kodea]

Giza metabolismorako duen garrantziagatik, sodio gatzak urte askotan merkatal produktu ugarienetarikoak izan dira, eta Erdi Aroan zehar sodanum izeneko gatz bat buruko minerako sendagai moduan erabili zen. Bere izena aplikazio horretatik datorkio, Arabiako suda (buruko mina esan nahi duena) hitzetik.
Sodioa beti konposatu desberdinetan aurkitu izan da, eta ez zen 1807. urterarte noiz Sir Humphry Davy zientzialariak isolatzea lortu zuen, sodio hidroxidoaren elektrolisiaren bitartez. 1809an, Ludwig Wilhem Gilbert fisikari eta kimikari alemaniarrak Natronium eta Kalium izenak proposatu zituen sodio eta potasioarentzat, hurrenez hurren. Sodioaren laburdura kimikoa 1814.urtean argitaratu zen, Jöns Jakob Berzelius-en eskutik. Na laburdura latineko natrium hitzetik dator, egiptoko hizkeraren natron mineralari erreferentzia egiten diona, sodio karbonato hidratatuaz osatuta dagoen gatz mineral naturala dena. 1860.urtean, Kirchhoff eta Bunsen sodioaren su garraren azterketa egin zuten, sodioaren garra hori kolorekoa zela ikasiz.
Produkzio komertziala[aldatu | aldatu iturburu kodea]
Sodio komertzializatu zen lehenengo aldia XIX.mendearen amaieran izan zen, 1100 °C-tan karbonato sodikoaren erredukzio karbotermikoaren ondorioz, aluminioa ekoizteko Deville prozesuaren lehenego pausuan:
Aluminioaren demanda handia zela bide, sodioa produzitzea beharrezkoa zen. Gaur egun komertzialki sintetizatzen da kloruro sodikoaren elektrolisitik, non NaCl kaltzio kloruroarerin nahasten den fusio tenperatura jaisteko asmoz.
Sodioa biltegiratzea eta garraiatzea ez da lan erreza, horregatik gas inertez betetako atmosfera itxi batean gorde behar da oxidatu ez dadin.
Aplikazioak[aldatu | aldatu iturburu kodea]
Sodio metalikoak aplikazio ugari dituen arren, sodio konposatuenak garrantzi handienekoak dira. Izan ere, sodioaren oxidoak eta gatzak hainbat industrietan oso erabiliak dira, sodio hidroxidoa, sodio karbonatoa eta hidruro sodikoa, adibidez. Sodio metalikoa sodio borohidruroa sortzeko erabiltzen da, baita sodio azida (NaN3) eta trifenilfosfina sortzeko ere. Askotan aleazioetan aurkitzen da, eta metalak erreduzitzeko (titanioaren eta zirkonioaren ekoizpenean) agente gisa erabiltzen da beste material batzuk eraginkorrak ez direnean. Honez gain, tetraetilberuna, beste gai organiko eta inorganiko ugari ekoizteko, eta polimerizazioen katalizatzaile moduan erabiltzen da.
Sodioa bere katioi eran dagoenean ioi-trukatzaile moduan erabiltzen da, gehienetan industriaren hondakin-uretan dauden metal astunak erauzteko. Hauek, sodio katioiekin ordezkatzen dira, hauek ez baitira toxikoak.
Eragin biologikoak[aldatu | aldatu iturburu kodea]
Gizakietan Na+ ezinbesteko osagaia da, non hau odoleko bolumena, presioa, oreka osmotikoa eta pH erregulatzen dituen. Egunean gutxienez 500 miligramo hartzea gomendatzen da, eta honen iturri nagusiena sodio kloruroa da, baina baita sodio glutamatotik, sodio nitritotik eta sodio bentzoatotik lortu daiteke ere. [4] Estimatzen da egunean hartu behar den kantitate normala 2.3 gramokoa dela, eta hau baino gutxiago hartzeak hipertentsioa eragin dezakeela, gaitz honek, mundu mailan, urtero 7.6 milioi pertsona hiltzen dituelarik. [5]
Segurtasuna eta neurriak[aldatu | aldatu iturburu kodea]

Sodioak urarekin kontaktuan hidrogenoa (erregarria) sortzen du[6], eta sodio hidroxido kaustikoak eratzen ditu. Hauek jatean edo azalarekin kontaktuan egotean erredura larriak sortu daitezke. [7] Sodioak airearekin kontaktuan egotean sua hartzen du. Hau ezin daiteke uretan oinarritutako su-itzalgailuekin itzali, soilik sutea areagotzen delako. Horrelako suteak itzaltzeko Met-L-X agenteak, edo Lith-X duten beste agente batzuk erabiltzen dira, grafitoa, organofosfato gar moteltzaileak eta harea dutenak. Erreaktore nuklearretan suteak ez gertatzeko sodioa isolatu egiten da oxigenoaren presentziatik, gas inerteak erabiliz.
Erreferentziak[aldatu | aldatu iturburu kodea]
- Artikulu honen edukiaren zati bat Lur hiztegi entziklopedikotik edo Lur entziklopedia tematikotik txertatu zen 2011/12/26 egunean. Egile-eskubideen jabeak, Eusko Jaurlaritzak, hiztegi horiek CC-BY 3.0 lizentziarekin argitaratu ditu, Open Data Euskadi webgunean.
- ↑ «Encyclopedia.com | Free Online Encyclopedia» www.encyclopedia.com (Noiz kontsultatua: 2019-04-01).
- ↑ Walter., Schumann,. (2008). Minerals of the world. (2nd ed. argitaraldia) Sterling Pub. Co ISBN 9781402753398. PMC 180907803. (Noiz kontsultatua: 2019-04-01).
- ↑ Denisenkov, P. A.; Ivanov, V. V.. (1987-05-01). «Sodium Synthesis in Hydrogen Burning Stars» Soviet Astronomy Letters 13: 214. (Noiz kontsultatua: 2019-04-01).
- ↑ «Wayback Machine» web.archive.org 2011-08-23 (Noiz kontsultatua: 2019-04-01).
- ↑ (Ingelesez) Geleijnse, J. M.. (2004-09-01). «Impact of dietary and lifestyle factors on the prevalence of hypertension in Western populations» The European Journal of Public Health 14 (3): 235–239. doi:. ISSN 1101-1262. (Noiz kontsultatua: 2019-04-01).
- ↑ 1956-, Girolami, Gregory S.,. (1999). Synthesis and technique in inorganic chemistry : a laboratory manual.. (3rd ed.. argitaraldia) University Science Books ISBN 0935702482. PMC 38495269. (Noiz kontsultatua: 2019-04-01).
- ↑ Gordon., Routley, J.. ([1993?]). Sodium explosion critically burns firefighters, Newton, Massachusettes [sic, October 25, 1992. ] United States Fire Administration PMC 36507144. (Noiz kontsultatua: 2019-04-01).
Bibliografia[aldatu | aldatu iturburu kodea]
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
Ikus, gainera[aldatu | aldatu iturburu kodea]
Kanpo estekak[aldatu | aldatu iturburu kodea]
- (Ingelesez) educaplus.org - Sodio
- (Ingelesez) WebElements.com - Sodio
- (Ingelesez) EnvironmentalChemistry.com - Sodio
- (Ingelesez) Es Elemental - Sodio

