ATP sintasa
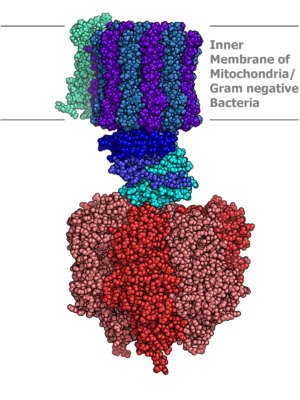
ATP sintasa edo ATP sintetasa zelula mintzean txertaturik dagoen transmintzeko proteina bat da ATP molekulak ekoizten dituena[1].
Hidrogeno protoien (H+) gradienteaz baliatuz ADP molekulak fosfato inorganikoarekin elkartu eta ATPak lortzen ditu mitokondrioen barneko mintzean (arnasketa zelularrean) eta tilakoideen mintzean (fotosintesiaren argitako fasean).
Egitura
[aldatu | aldatu iturburu kodea]ATP sintasa 10 nm-tako diametroa duen proteina konplexua da. Bi konplexu nagusi ditu, F0 eta F1.[2]
F0 konplexua mintzean txertaturik dagoen zatia da. Azpiunitate batzuek osatzen dute, a, b2 eta c10-14 unitateek hain zuzen ere. C azpiunitateek eraztun bat osatzen dute eta H+ gradienteari erantzunez errotatzen hasten dira. F1 konplexua mintzetik ateratzen den zatia da eta bertan lortzen dira ATP molekulak. Bigarren konplexu honek ere hainbat azpiunitate ditu, α3, β3, γ, δ eta ε. Aipaturiko c eraztunarekin batera γ eta ε azpiunitateek biratu egiten dute eta 120º bakoitzeko α3 eta β3-ri konformazio aldaketak eragiten dizkiete. b2OSCP1 (Oligomycin Sensitiviy Conferring Protein) azpiunitateek F0 eta F1 konplexuak lotzen dituzte[3].
ATP sintasaren funtzionamendua
[aldatu | aldatu iturburu kodea]
I konplexua (NADH deshidrogenasa)
II konplexua (Sukzinato deshidrogenasa)
Q koentzima (Ubikinona)
III konplexua (Zitokromo bc1)
C zitokromoa
IV konplexua (Zitokromo oxidasa)
ATP sintasa
ATP molekulen sintesia formula honen bidez deskribatzen da:
- ADP + Pi + nH+p → ATP + H2O + nH+P
Arnasketa zelularrean mitokondrioaren matrizean egiten den Krebs zikloan gertatzen da. Ziklo honetan NADH + H+ eta FADH2 koentzima erreduzituak sortzen dira eta mitokondrioaren gandorretan kokaturiko elektroien garraio kateko proteina konplexuetara joaten dira. Bertan oxidatu egiten dira eta elektroiak eta H+ak askatzen dituzte. Kate horretan dauden proteina konplexuek (I, III eta IV) H+ak mintz arteko gunera pasatzen dituzte eta eremu hori asko azidotzen denez gradiente handia sortarazten dute. Protoi hauek barrura itzultzeko joera izaten dute eta horretarako bide bakarra ATP sintasatik pasatzea da. Sartzen den hidrogeno protoi bakoitzeko ATP sintasak 120º biratzen ditu, horrela beraz, hiru pasatzen direnean bira osoa ematen du eta ATP molekula bat sintetizatzen du[2][4].
Antzera gertatzen da fotosintesiaren argitako fasean tilakoideen mintzean. Tilakoide barneko lumenean argi izpiak ur molekula hidrolisatzen duenean H+ak askatzen dira eta gradientea sortzen da. Tilakoidetik ateratzeko bide bakarra ATP sintasa dute[5].
Historia
[aldatu | aldatu iturburu kodea]1960 eta 1970 hamarkadetan Paul D. Boyer estatubatuarrak ATP sintasaren errotazio ahalmena deskribatu zuen eta horri esker ATPa ekoizten zela esan zuen[6]. John E. Walker biokimikari kanadarraren taldeak[7] 1994 urtean F1 konplexuaren egitura kristalinoa argitaratu zuen eta F0 eta F1 artean protoiak nola igarotzen diren azaldu zuen[8]. Ikerlari biek 1997an Kimikako Nobel Saria irabazi zuten[9].
Erreferentziak
[aldatu | aldatu iturburu kodea]- ↑ (Ingelesez) Okuno, Daichi; Iino, Ryota; Noji, Hiroyuki. (2011-06-01). «Rotation and structure of FoF1-ATP synthase» The Journal of Biochemistry 149 (6): 655–664. doi:. ISSN 0021-924X. (Noiz kontsultatua: 2020-01-18).
- ↑ a b «Zelulen motor birakaria» Zientzia.eus (Noiz kontsultatua: 2020-01-18).
- ↑ Smith, Marks, Lieberman. (2005). «21». Bioquímica básica de Marks, un enfoque clínico. Lippincott Williams & Wilkins, 325-330 or. ISBN 0-7817-2145-8..
- ↑ Christopher K. Mathews, K. E. Van Holde, Kevin G. Ahern. «15». Bioquímica. Pearson Educación, S.A., 600-615 or. ISBN 9788478290536..
- ↑ Junge, Wolfgang; Nelson, Nathan. (2015-06-02). «ATP Synthase» Annual Review of Biochemistry 84 (1): 631–657. doi:. ISSN 0066-4154. (Noiz kontsultatua: 2020-01-18).
- ↑ (Ingelesez) «The Nobel Prize in Chemistry 1997» NobelPrize.org (Noiz kontsultatua: 2020-01-18).
- ↑ «John Walker: "Biomakinen zatiak erabili beharrean, hobe da haien oinarri kimikoa ulertu eta aplikatzea"» Zientzia.eus (Noiz kontsultatua: 2020-01-18).
- ↑ (Ingelesez) «The Nobel Prize in Chemistry 1997» NobelPrize.org (Noiz kontsultatua: 2020-01-18).
- ↑ (Ingelesez) «The Nobel Prize in Chemistry 1997» NobelPrize.org (Noiz kontsultatua: 2020-01-18).
