Mintz potentzial
Mintz potentziala zelula baten mintzaren kanpo eta barnealdearen arteko boltai aldaketa da. Potentzial diferentzia hau mintza zeharkatu dezaketen ioien kontzentrazio ezberdinak sortzen du, eta ezinbestekoa da zelulen aktibitate egokirako. Bere funtzio nagusia ekintza potentziala burutzea da, honen bidez, besteak beste, nerbio garraioa edo muskuluaren uzkurketa gertatzen baita. Atseden egoeran gizaki zelula gehienetan -70 mV eta -90 mV artean egoten da. Mintz potentziala mintz plasmatikoa zeharkatzen duten proteinek sortzen dute gehien bat. Bigeruza lipidikoa zeharkatzen duten kanalek eta ponpek ioien iragazkortasuna eta, ondorioz, barne eta kanpoaldearen arteko kontzentrazio ezberdintasuna kontrolatzen dute. Sodio, potasio eta kloro dira kontzentrazio altuenean agertzen diren ioiak, eta ponpen artean ponpa da garrantzitsuena. Honek etengabe kanporatzen ditu 3 eta 2 barneratu, ziklo bakoitzean ATP molekula bat gastatuz eta karga positibo bat gehiago kanporatuz. Energia gastu honen bidez atseden potentziala mantendu daiteke egoera egonkorrean. Ioi eta ponpa hauez gain garrantzia handia dute zelula barruko ioi negatibo handiek. Hauek normalean proteinak dira, negatiboki kargatuak, eta ezin dute mintza zeharkatu. Kitzikagarriak ez diren zeluletan atseden potentzial honek balio konstantea mantentzen du, baina zelula ziztaberetan mintz potentziala asko aldatzen da. Honen adibide garbiena neuronak dira: kitzikapen nahikoa jasoz gero ekintza potentziala sortu eta garraiatzeko gai dira. Mintz potentziala -90 mV inguruko atseden baliotik despolarizatu eta balio positibo batera iritsi arte aldatuko da, eta honen ostean atseden balioa berreskuratu. Aldaketa bortitz hau boltai menpeko kanalen menpe dago, eta dena edo ezer ez motakoa da, atari potentzial bat gainditu behar da gertatu ahal izateko.

Mintz plasmatikoa[aldatu | aldatu iturburu kodea]
Mintz plasmatikoa zelulen estalkia da eta beharrezkoa da euren biziraupen eta funtzionamendurako. Bizitza garatu ahal izateko ezinbestekoa izan zen zerbaitek ixtea, sustratu ezberdinen artean erreakzio kimikoak gertatu ahal izateko. Ondorioz bizitzaren oinarrian dago mintza eta hainbat funtzio betetzen ditu zelularen bizitzan. Gaur egun mosaiko bat bailitzan deskribatzen da: bigeruza lipidikoa da oinarria eta honen inguruan hainbat proteina eta egitura ezberdin antolatzen dira. Oso aldakorra da.

Mintz plasmatikoa bigeruza lipidiko bat da, eta fosfolipidoz osatua dago.
Urarekin kontaktuan duten portaeraren arabera substantzia hidrofobikoak eta hidrofilikoak ezberdindu daitezke. Lehenengoak saiatuko dira ura sahiesten, eta bigarrenak urarekin kontaktua bilatuko dute. Substantzia anfipatikoek zati hidrofobiko eta hidrofilikoa dute, eta berez bigeruza artifiziala sor dezakete indar kimikoen eraginaz, hau da, elkarrekintza hidrofobikoarengatik. Fosfolipidoen kasuan gantz azidozko bi buztanak hidrofoboak dira eta burua molekula hidrofiliko bat izaten da.

Ura eta olioa berez ez dira elkartzen disoluzio batean, ur molekulek entropia gehiago izango luketelako olio tanta txiki bakoitzaren inguruan antolatzerakoan. Izan ere, ur molekulek lotura sendoagoak lortzen dituzte beste ur molekulekin, hidrogeno zubien bidez, olioarekin baino. Ur molekulak olioarekin kontaktuan jartzerarkoan hidrogeno zubiak ez apurtzeko norabidean jartzen dira, mugitzeko askatasun pixkat galduz eta euren entropia txikituz. Ondorioz entropia gehiago lortzen da olio eta uraren arteko azalera kontaktua gutxituz. Tentsioaktiboak substantzia anfifilikoak dira eta gainazal tentsioa jaisten dute. Tentsioaktiboa ura eta olioarekin elkartzean, bi substantzien artean jarriko da: uretan disolbagarriagoa den zatia uretan eta lipofilikoa oliotan. Tentsioaktibo nahikoa badago ur-olio interfase guztian zehar hedatuko da, olioa eta uraren arteko kontaktua ekidinez.
Tentsioaktibo gehiagorekin ur-olio azalera handituko ahalko da, tentsioaktibo gehiago egongo delako tartean jartzeko, eta tamaina ezberdineko tantak eratuko dira. Ondorioz ura eta olio disoluzioa homogeneizatuz joango da. Hau da maionesa egiterakoan lezitinak (arrautzako fosfolipidoa) egiten duena.
Uretan tentsioaktiboak botata hauek mizela izeneko egituran antolatzen dira berez. Alde hidrofilikoa urarekin kontaktuan gelditzen da, esfera baten itxura hartuz, eta zati hidrofobikoa esferaren barnealdean gelditzen da. Modu honetan zati hidrofobikoa ez dago kontaktuan urarekin.
Mizelak antolatzeko tentsioaktiboek itxura konikoa izatea oso garrantzitsua da. Modu honetan buru zabalagoa urarekin kontaktuan geldituko da eta esfera itxiko du, barnean buztana utzita. [1]
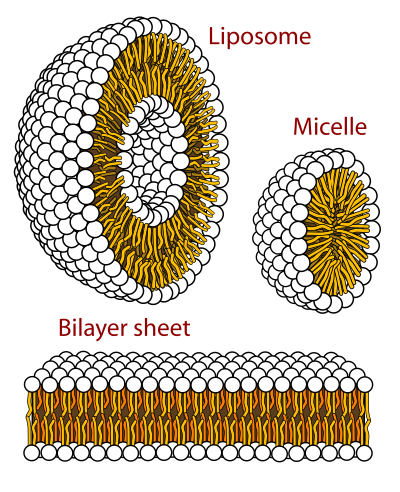
Mintz plasmatikoa, ordea, ez da mizela batean antolatzen, bigeruzan baizik. Izan ere, mintzeko fosfolipidoek bi buztan dituzte, bi gantz azido. Hortaz, buztan bakarreko mizelak baino energia bikoitza irabaziko lukete. Bigeruzaren alboan gantz azidoak urarekin kontaktuan ez gelditzeko bigeruzak ixteko joera dauka, eta bixikula handiak sortzera irits daitezke. 10 -ko bixikulak ere egin daitezke, zelula eukariotikoaren tamaina gutxi gora-behera. Zelularentzat bigeruzak beste abantaila batzuk ere baditu:
Fosfolipidoak lortzea erraza da.
Fosfolipidoek mugatzen dute mintzaren lodiera buztanen luzeraren bidez, eta honek zehaztuko du substantzia ezberdinekiko iragazkortasuna, kapazitate elektrikoa, eta ezaugarri mekanikoak.
Gainera egitura honek ahalbidetzen du zati hidrofiliko eta hidrofobikoak duten substantziak sartzea. Hau funtsezkoa da zelularen biziraupenerako beharrezkoak diren proteina asko zati hidrofobiko eta hidrofilikoak dituztelako, eta bere funtzioak betetzeko mintzan sartuta kokatu behar direlako. Proteinak batzuk mintzan ezarri eta alde baterantz utziko dute zati hidrofilikoa, eta beste batzuk mintz guztia zeharkatuko dute, mintzaren kanpo eta barnealdeko komunikazioa eginez.
Naturak entropia maximizatzeko eta energia minimizatzeko joera dauka, entropia handien eta energia gutxien duen egoera izango da termodinamikoki faboragarriena. Entropia handitzeko mintzak itxi behar du, alboko fosfolipidoen gantz azido hidrofobikoak urarekin kontaktuan ez egoteko; baina energia aske gutxien duen konfigurazioa bigeruza lauarena da. Izan ere, kurbatzerakoan, buruak bananduko dira eta ur pixkat sartuko da. Ixteko joera mizelen kasuarena baina handiagoa izango da, buztan hidrofobiko baten ordez bi gelditzen direlako urarekin kontaktuan.
Zeluletan mintza asimetrikoa da, fosfolipido ezberdinak ditu kanpo eta barne geruzetan, eta honek laguntzen du mintza kurbatzen.
Mintzak bigeruza lipidikoa eratzeagatik kapazitantzia bat dauka, kargatua dagoelako. Artifizialki eratutako bigeruzak eta biologikoak antzeko kapazitantzia dute, . Hau neurtuz mintzaren lodiera lor daiteke:
Hemengo mintzaren azalera litzateke -tan, mintzaren lodiera eta konstantea. Mintz artifizialek biologikoak baino askoz erresistentzia gutxiago jartzen dute, konduktantzia handiagoa. Honen arrazoia mintza zeharkatzen duten proteinak dira. Proteina hauen adibide gero ikusiko diren boltai menpeko kanalak izan daitezke.[1]
Mintza mosaiko bat bezala deskribatzen da. Bigeruza lipidikoa da eta fosfolipidoen artean proteinak, kolesterola eta beste hainbat molekula egongo dira ezagupenerako, loturetarako, ... Gainera etengabeko mugimendua izango dute fosfolipidoek: euren buruen inguruan biratuko dute eta baita alborantz ere. Batzuetan geruzaren alde batetik bestera salto ere egin dezakete. Mintza oso aldakorra izango da, eta inguruneko aldaketei erantzungo dio.
Gainazaleko karga[aldatu | aldatu iturburu kodea]
Mintzaren barnekaldea negatiboki kargatua dago. Izan ere mundu mikroskopikoan errazagoa da molekulak ionizatzea: Demagun ur tanta baten molekulen ehuneko bat ionizatzen direla, tanta baten geruzean geldituz elkarrengandik aldentzeko. Honetarako behar den energia izango da. Tantaren kargaren balioa ur molekulen dentsitate, bider tantaren bolumena bider protoiaren karga, bider ionizatzen diren partikulen ehunekoa izango da. Tantaren erradioa milimetro batekoa hartuz eta partikulen ehuneko bat ionizatzen bada lortzen da. Ondorioz, energia asko behar da ur tanta bat airean ionizatzeko. Kalkulo berdina eginez gero uretan, non den, energia gutxiago beharko da. Kasu honetan, mikrometro bateko erradioko tanta hartuta lortzen da. Nanometro bateko erradioa erabiliz gero balio txikiagoa lortzen da: . Ondorioz, mundu mikroskopikoan ez da horren zaila molekulak ionizatzea, ez da horrenbeste energia behar, eta soilik energia termikoaren eraginez molekula neutro bat hautsi daiteke bi zati kargatuetan. Honek frogatzen du zelularen mintzaren inguruan karga askeak ibiliko direla. Hala ere, ikuspegi makroskopikotik ikusita elektroneutralitatea mantentuduko, hau da, karga positibo eta negatiboen kopurua berbera izango da. Izan ere, mintzaren inguru nahiko txikia aukeratuz gero ez makroskopiko kontsideratu daiteke eta gaur egungo tresneriarekin potentzial diferentzia neurtu.
Helmholtz-en eredua[aldatu | aldatu iturburu kodea]
Disoluzioan ionizatzea errazagoa denez mintzatik karga positiboak askatuko dira, eta negatiboki kargatua geldituko da. Honek ez du elektroneutralitatea apurtzen, mintzeko katioiak disoluzioan geldituko direlako, eta makroskopikoki begiratuta karga kopuru negatibo eta positibo berbera mantenduko dela. Mintza negatiboki kargatua egoteagatik katioiak erakarriko ditu. Katioiek disoluzioan ur molekulak dituzte inguruan. Batzuk euren inguruan antolatutako ur molekula geruza galduko dute eta mintzan lotuko dira, eta beste batzuk ez dute energia nahikoa izango horretarako. Azken hauek euren hidratazio geruzak ahalbidetzen dien distantziara geldituko dira, hidratazio erradiora hain zuzen ere. Mintzaren distantzia batera mintzaren karga negatiboak konpensatzeko katioi geruza antolatuko da. Gainazaleko kargak potentziala sortuko du, eta hau linealki jaisten joango da katioien hidratazio erradiora arte. Hemendik aurrera potentziala zero izango da. Helmholtz eredu hau hurbilketa ona da gainazaleko potentzialerako, baina honetarako suposatu da katioiek ez dutela higidura termikorik jasaten eta hidratazio erradioko distantzia finkora geldi mantentzen zirela.
Gouy-Chapman-en eredua[aldatu | aldatu iturburu kodea]
Mintza negatiboki kargatua egongo denez, honen inguruan karga positiboko geruza bat antolatuko da, aurreko ereduan ikusi bezala. Orain, berriz, higidura termikoarengatik katioiak eta anioiak egongo dira mintzaren inguruan, baina katioiak gehiago izango dira negatiboki kargatutako mintzak erakarriko dituelako. Energia termikoaren eraginez katioiak ez dira mintzatik distantzia zehatz batera paraleloki banatuko, baizik eta geruza hodeitsu batean. Mintzaren azaleraren kargak potentzial bat sortuko du disoluzioan. Potentzial honek katioiak erakartzean potentziala bera murriztuaraziko da. Aitzitik, kasu honetan potentziala ez da erabat desagertuko geruza honetik aurrera, gutxinaka murriztuz joango da difusio eremuan zehar, eta azkenean, mintzatik urrun anulatuko da. Hortaz, potentziala mintzaren karga eta inguruko katioien menpe egongo da.
Azalpen matematikoa[aldatu | aldatu iturburu kodea]
Poisson-en legearen arabera: , 3 dimentsiotan. Hemen soberako katioiak izango dira, mintzetik hurbil geldituko direnak. Zelula gehienek diametro erlatibo handia dutenez mintza xafla lau kargatua bezala har daiteke. Gainera, kontuan izanda mintz gainazaletik bi norabideak baliokideak izango direla dimentsio bakarreko problema bezala azter daiteke. Azkenik, mintzaren gainazalean zehar karga modu homogeneoan banatzen dela suposatuz:
Potentzial kimikoa espezie ioniko batentzat ondokoa izango da:
Hemengo ze ioiaren karga izango da, e elektroiaren karga izanda. V potentziala izango da, Boltzmannen konstantea, T tenperatura eta a aktibitatea. Disoluzioa idealtzat hartuta aktibitatea (a) ioiaren kontzentrazioarekin (c) ordezkatu daiteke.
Mintzatik urrun potentziala anulatuko dela kontuan hartuta:
Adierazpen hau goikoan ordezkatuz, eta kontzentrazioa bakanduz honakoa lortzen da:
Hau Boltzmannen banaketa da. Honekin karga dentsitatea kalkulatu daiteke:
Karga dentsitatea Poissonen legean ordezkatuz:
Honen muga baldintzak honakoak izango dira:
Balentzia bateko elektrolitoaren kasuan honakoa lortzen da:
non
Hemengo Debyeren luzera deitzen da, eta geruza hodeitsuaren kokapena adierazten du. Ikus daitekeenez Debye luzera txikitzen da disoluzioaren kontzentrazioa handitzean, -ren proportzionala baita. Ekuazio honek potentzialaren erorketa handia adierazten du, esponentzialki, gainazaletik () urruntzerakoan, infinituan anulatu arte.
Poisson-Boltzmann ekuazioa sinplifikatu daiteke denean (z=1 eta T=300 K izanda V=25mV-erako gutxi gora-behera) Orduan, potentziala txikia den kasuetan, hurbilketa egin daiteke, ekuazioa errazteko. Hurbilketa honekin Poissonen ekuazioa honela gelditzen da:
eta honen soluzioak zuzenean lortzen dira:
Ekuazio honen arabera potentziala esponentzialki murriztuz joango da gainazaleko baliotik, Debye luzeran lortuz. [2]
Geruza hodeitsuaren karga[aldatu | aldatu iturburu kodea]
Mintzaren gainazaleko karga eta disoluzioaren katioiek eragindakoa erlaziona daitezke. Mintzaren gainazalak gainazaleko karga izango duela kontuan hartuz, geruza hodeitsu horretan egongo da. Hortaz, soberako katioi guztien batura, mintzatik infinitura eman beharko du. Hau integratuz 0-tik infinitura:
oso handia denean izango da eta gainazaleko potentziala gainazaleko kargaren nepertarrarekiko proportzioanala izango da. Potentziala txikia denean, berriz, hurbilketa hau egin daiteke:
Hortaz, gainazaleko karga eta potentziala zuzenki proportzionalak dira.
Debye luzera batzuetatik urrun limitean, eta 1:1 elektrolitoaren hurbilketak mantenduz, potentziala honela idatz daiteke:
Hau lortzeko erabili da den kasurako. Jakiteko hurbilketa egin daitekeen edo ez, eta zein ekuazio erabili behar den mintzen potentziala neurtu behar da. Erabilitako hurbilketa hauek ez dute modu egokian deskribatzen zeluletako egoera, gehienek atseden potentziala 25 mV baino handiagoa izaten dutelako, normalean 50-100 mV-eko tartean.

Laburbilduz, gainazal kargatuarengatik geruza hodeitsu bat sortuko da, karga positibokoa. Geruza honek mintzaren karga negatiboak sortutako potentziala estaliko du. Modu honetan zelulatik dabiltzan ioiak ez dira ohartuko gainazal kargatuaz mintzara asko hurbildu arte, distantziara geruza hodeitsua gurutzatu arte. Debye-ren luzera 0.1 M-eko kontzentraziorako 1 nm-koa da. Mintzetik bi edo hiru -ra disoluzioa elektroneutrala kontsideratu ahalko da, gainazaleko kargek ia eraginik izango ez dutelako. Hau da makroskopikoki espero daitekeena. Funtsean energiaren eta entropiaren arteko lehia bezala azter daiteke ioien banaketa. entropiaren ekarpena litzateke eta energiarena. Sistemak joko du energia askea minimizatzera. Disoluzio ez idealen kasuan gai hauek mantentzen dira baina zuzenketak behar dituzte kontuan hartu delako molekulek tamainarik ez dutela eta euren arteko elkarrekintzak arbuiatu direlako. Azken hurbilketa hau soilik erabil daiteke ioien kontzentrazioa baxua denean.
Bi ereduak elkartuta[aldatu | aldatu iturburu kodea]
Zeluletan bi ereduetan deskribatutakoa gertatuko da aldi berean. Katioi batzuk mintzara elkartuko dira. Gainazaletik hona modu linealean aldatuko da potentziala. Beste katioi batzuk distantzia batera mantenduko dira ur molekulez inguratuta, geruza hodeitsua osatuta, eta hemendik aurrera modu esponentzialean apalduko da potentziala mintzetik urruntzean. Debye luzeratik aurrera potentziala oso txikia izango da, eta asko urruntzean anulatuko da.
Ioi garraioa[aldatu | aldatu iturburu kodea]
Ioi garraioa eta mintz potentziala estuki erlazionatuta daude. Ioien mugimenduak mintz potentziala sortzen du, eta mintz potentzialak ioien garraioa. Garraio hau gertatzeko bigeruza lipidikoa zeharkatzen duten proteina batzuk daude, ioi kanalak eta ponpak. Garraio mota ezberdina daude:
Garraio pasiboa[aldatu | aldatu iturburu kodea]
Ioi batzuk mintza zeharkatu dezakete difusioz, gradiente elektrokimikoaren alde, energia gasturik gabe. Kloroa da honen adibide.
Garraio pasibo erraztua[aldatu | aldatu iturburu kodea]
Garraio mota honetan ez da energiarik erabiltzen baina mintza zeharkatzen duen proteina bat behar da. Aurrekoarekin alderatuz, garraio pasibo erraztuan garraio abiadurak muga bat aurkezten du kontzentrazioa igotzean. Azukrea eta aminoazido gehienak modu honetan barneratzen dira. Difusio abiadura kontzentrazioa, Nernst potentziala, eta presio osmotikoaren menpe dago.
Garraio aktiboa[aldatu | aldatu iturburu kodea]
Garraio aktiboa energia gastatzen duena da. Mintza zeharkatzen duen proteina baten bidez burutzen da, ATP erabiliz. Hau da sodio eta potasioa jasaten dutena gradiente elektrokimikoaren kontra mugitzeko ATPasaren bidez.

Bigarren mailako garraio aktiboa[aldatu | aldatu iturburu kodea]
Kasu honetan gradientearen aldeko ioi baten mugimendua baliatzen da beste molekula bat gradientearen kontra eramateko mintza zeharkatzen duen proteina baten bidez. Energia gastua gradientearen alde joan den ioiaren egoera berreskuratzeko gertatzen da. Honen adibide bat sodio eta azukrearen kogarraioa da: sodioa gradientearen alde sartzen da zelulara eta aldi berean azukre molekula bat gradientearen kontra sartzea ahalbidetzen du. Gero sodio potasio ponpak sodioa berriz kanporatzeko ATP erabiliko du. Sodioa aminoazidoak, kaltzioa edo hidrogeno ioiak ere gradientearen kontra eramateko erabiltzen da. [3]
Mintz potentziala[aldatu | aldatu iturburu kodea]
Gibbs-Donnan oreka eta oreka potentziala[aldatu | aldatu iturburu kodea]
Zelula barnean molekula asko dago, ur disoluzio antzeko batean. Kanpoan, ordea, askoz molekula gutxiago egon ohi da, itsaseko uraren antzeko disoluzioa baita. Ondorioz, zelula barneko molekulek kanpora irteteko joera izango dute, kontzentrazioak berdintzeko, hau da, euren entropia ahalik eta handien egiteko. Zelula barnean hainbat molekula mota ezberdindu daitezke: kargarik gabeko molekulak (glukosa,...), molekula kargatu txikiak (ioiak), molekula kargatu handiak (proteinak, DNA, ...), eta ura. Zelularen tamaina gutxi gora-behera konstante mantentzen dela suposatuz uraren mugimendua mintzean zehar arbuia daiteke. Izan ere, ur asko sartzen bada zelulak eztanda egin dezake, eta gehiegi aterako balitz zimurtu eta hil egingo litzateke. Kargarik ez duten molekulek ez dute mintz potentziala eragingo, eta horregatik ez dira kontuan hartuko eredu honetan. Mintz potentziala sortzeko molekula kargatuak dira garrantzitsuenak, eta horiek aztertuko dira. Proteina edo DNA bezalako molekula kargatu handiek ezin dute berez mintza zeharkatu, eta zelula barnean geratzen dira. Bestelako ioi txikiak, berriz, mintza zeharka dezakete. Zelula barneko ioiak difusioz irtengo dira zelulatik, euren entropia handitzeko. Fick-en 1. legearen arabera:

D difusio konstantea eta c kontzentrazioa izango dira. Ondorioz J hau kontzentrazio ezberdintasunak eragindako fluxua izango da. Ioiek mintza zeharkatzerakoan barnekaldea negatiboki kargatua geldituko da, negatiboki kargatutako proteinek ezin dutelako atera. Ondorioz katioiak barrurantz bultzatuak izango dira. Katioien irteerak, beraz, eremu elektriko bat sortu du, eta honen eragina katioiengan ondokoa izango da: Abiadura hau eremu elektrikoarengatik katioiaren abiadura maximoa izango da eta "marruskadura koefizientea". q katioiaren karga izango da. -n kasuan izango da. Aterako diren ioiak mintzatik oso hurbil geldituko dira, mintzatik urrun bi disoluzioen karga neutralitatea mantenduz. Eremu elektrikoak eragindako fluxua izendatuz: Bi fluxuak batuta ondokoa geratuko da:
Hemen Einsten-en erlazioa erabiliz,
Oreka egoeran ez da fluxurik egongo eta J=0 izango da:
Hau integratuz:
eta hemendik, q=ze eginez, eta

Ondorioz ioien kontzentrazio ezberdinak potentzial diferentzia bat sortzen du oreka egoeran. Potentzial diferentzia honi Nernst potentziala deritzo, eta mintza gurutzatu dezakeen edozein ioik eratuko du. Zeluletan eta dira mintza gehien zeharkatzen dutenak. Hauek eta barruan kargaturiko makromolekulak (proteinak batez ere) kontuan hartuz, honela idatz daiteke karga neutralitatearen baldintza mintzaren bi aldeetan: Kanpoan:
Barruan:
Kanpoko disoluzioaren kontzentrazioak ezagututa, barruko kontzentrazioak eta lor daiteke. Honetarako aurreko bi ekuazioak eta ioi bakoitza orekan dagoelako erabili daiteke.
Eta hiru hauen artean:
Egoera honi Gibbs-Donnan oreka deritzo, eta hiru ioi hauek sortutako potentzialari Donnan potentziala.
Ioi bakoitzak sortutako potentziala ordezkatuz:
Ikus daitekeenez potentzial bat mantendu daiteke inolako energia gasturik gabe, oreka egoeran, soilik ioien kontzentrazio gradienteengatik. Gradiente hau anioi handiek mintza gurutzatzeko ezintasunak eragiten du.
Donnan orekak aurresaten du barnean negatiboki kargatuak dauden molekula handiengatik sodio eta potasioa barrurantz etorriko direla eta kloroa aterako dela mintzatik kanpora. Modu honetan lortuko da.
Kontzentrazio ezberdintasun honek presio osmotiko bat eragingo du, mintzak eutsi beharko lukeena. Kanpo eta barneko molekula guztiak batuz neurtzen da. Van't Hoff ekuazioaren bidez kontzentrazio gradienteak sortutako presioa kalkulatu daiteke: . Oso presio handia lortzen da, mintza hautsiko lukeena. Landare, onddo edo algek, adibidez, pareta zelularra dute, eta honi esker presio osmotiko handiagoak jasan ditzakete, baina zelula eukariotikoek ez dute horrelakorik. Ondorioz Gibbs-Donnan oreka ez da gertatzen normalean zeluletan. Izan ere, izaki bizidunen zelulak orekatik oso urrun daude. Oreka soilik heriotzan lortuko dute.
Egoera egonkorra[aldatu | aldatu iturburu kodea]
Energia gastua[aldatu | aldatu iturburu kodea]
Egoera egonkor bat mantentzeko energia erabili behar da. Energia hau zelularen metabolismotik dator eta ioi ponpaketaren arduraduna da. Zelula barne eta kanpoan ioien kontzentrazioa neurtuta ioi bakoitzarentzat ezberdina lortzen da:
Datu hauek erabiliz honako potentzialak lortzen dira:
Bestetik, zelula honetan neurtutako mintzaren atseden potentziala da. Honek baieztatzen du zelulak ez daudela orekan, egoera geldikor batean baizik. Mintz potentziala ioi bakoitzaren atseden potentziala ez denez, mugitzeko joera izango dute ioiek: non ioiaren konduktantzia ohmikoa den. Hau Ohm-en legea da pixkat aldatuta:
Egoera geldikor hau mantentzeko energia gastua egongo da: ponpa. Hau mintzan zehar dagoen proteina da, eta ziklikoki hiru sodio kanporatuko ditu eta bi potasio barneratu ATP energia molekula bat gastatuz.
Honen eraginez eta -k beste gai bat izango dute, eta honek mintz potentzialari ere ekarpen txiki bat emango dio. ATPasak behar du aktibatzeko, sodio eta potasioaz gain, eta kaltzio ioiek inhibitzen dute. Ponpa honen blokeoa hasieran mintzaren potentziala pixkat jaistea eragingo du, ponpak eragiten zuen potentzial diferentzia, baina honek ez du eraginik kitzikagarritasunean. Minutu batzuk pasatzerakoan, berriz, atseden potentzialak murrizten jarraitzen du, ponpa funtsezkoa baita honen mantenurako eta azkenean atseden potentziala eta kitzikagarritasun guztia galtzen da. Zeluletan ponparen aktibitatea aldatu egiten da aktibitate elektrikoaren arabera.
Planck-Nernst ekuazioa[aldatu | aldatu iturburu kodea]
Donnan oreka lortzeko Fick-en 1. legea erabili da, baina oreka egoera zelula bizietan gertatzen ez denez, denborarekin aldatzen dela kontuan hartu behar da. Zuzenketa honen bidez lortutakoari Planck-Nernst ekuazioa deitzen zaio. Hau lortzeko jarraitasunaren ekuazioa erabil daiteke:
Ekuazio honetan Fick-en legea ordezkatuz:
Ekuazio hau erabiliz azter daiteke mintzaren garraioa denboran zehar kontzentrazioak aldatzerakoan. Fick-en legeak kontzentrazio gradienteak eragindako mugimenduak aztertzeko balio du, baina potentzialak ere eragina izango du. Indar entropikoaz gain indar energetiko bat egongo delako. Kasu honetarako fluxua gradiente elektrokimikoaren aldaketaren proportzionala izango da, gradiente elektrokimikoak eragingo du mugimendurako indarra:
Proportzionaltasun konstantea, unitateak berdintzeko izango da, ioi bakoitzaren mobilitatea izanik, indar unitateko abiadura dena. Gradiente elektrokimikoa ordezkatuz eta deribatuz:
F Faradayren konstantea da, eta R gasen konstante unibertsala. Hau Nernst-Planck-en elektrodifusioaren ekuazioa da. Ekuazio hau aurretik Gibbs-Donnan orekarako lortutako ekuazioaren antzekoa da, baina beste bide batetik erdietsita. Biak alderatuz, ikus daiteke dela, eta hau Einsteinen erlazioa da konstante batzuk aldatuta. Hortaz, mobilitatea eta difusio konstatea parekoak dira: bata kontzentrazio gradientearen kasuan agertzen da, eta bestea gradiente elektrokimikoarekin. Ioien fluxuak sortuko duen korrontea honakoa izango da:
Bestetik, Nernst-Planck ekuazioaren bigarren gaia Ohm-en legearen berdina da:, non g konduktibitatea den. g mobilitate eta difusio konstatearekin erlaziona daiteke:
Difusio ekuazioak kontzentrazio eta potentzialaren deribatuak dituenez, errazteko, hauetako bat hartu eta bestea ondorioztatuko da. Goldman-ek proposatu zuen bezala eremu elektriko konstantea hartuta:
Hemengo mintzaren lodiera izango da. Hau Nernst-Planck ekuazioan ordezkatuz:
Hemendik aurrera i azpiindizeak ez dira idatziko, baina fluxua ioi guztientzat gertatuko da. Azken ekuaziotik konstantea definituz:
Muga baldintzak aplikatu behar dira. Ez da denbora kontuan hartu behar egoera egonkorraren eraginez fluxua konstantea delako. Mintz barneko kontzentrazioa disoluzioarenaren berdina bailitzan hartuko da, kalkulua errazteko. x=0 denean kontzentrazioa bada, -ko potentzialarekin, eta x=L denean eta . Potentziala izanik. Muga baldintza hauek erabiliz goiko ekuazioan integratuz eta integrazio konstanteak kalkulatuz honakoa lortzen da:
Hemengo A berriz ordezka daiteke ekuazioa iragazkortasun konstantearen menpe uzteko: . Eta honen ondorioz:
Ekuazio honetan ikus daiteke potentzial positibo handia ezartzerakoan . Honetik kargen fluxua eta konduktibitatea lor daitezke berriz ere: eta . Aplikatutako potentziala positiboa den kasuan konduktibitatea -ren menpekotasuna erakusten du, hemengo katioiak mugituko baitira. Aplikatutako potentziala negatiboa denean lortzen da, espero bezala -ren menpe. Beste limite interesgarria -koa da. Kasu honetan hurbilketa egin daiteke, eta fluxua honela gelditzen da:
V=0 limitean difusio sinplearen ekuazioa berreskuratzen da:
Goldman-Hodgkin-Katz ekuazioa[aldatu | aldatu iturburu kodea]

Aurreko atalean ioi bakoitzaren garraioa aztertu da potentzialaren arabera. Baina mintz potentzialean ioi guztiek parte hartzen dute. Horregatik ioi guztien garraioa batu beharko da korronte fluxua lortzeko:
Ioi bakoitzak sortutako korrontea honakoa izango da:
1. gaian agertzen denez katioi eta anioien korrontea batuko da, eta ioiaren zeinua esponentzialean agertuko da soilik. Orekan, ioi baten kasuan Gibbs-Donnan orekan lortutako emaitza bera lortzen da:
Ioi guztien baturari oreka baldintza aplikatuz gero, sodioa, potasioa eta kloroa kontuan hartuz:
eta potentziala:
Hau da Goldman-Hodgkin-Katz ekuazioa. 0 goi indizedun kontzentrazioak mintzatik kanpokoak dira, eta L dutenak barrukoak. Indizeak aldatuz, 0-tik kanpoko k-ra eta L-tik barruko b-ra:
Ikus daitekeenez ioi bakoitzaren potentzial elektrokimikoaren antzekoa da, baina hemen mobilitatea agertzen da. Leku askotan iragazkortasuna edo permeabilitatea deritzon P agertzen da u-ren ordez. Honek adierazten du ioi bakoitzaren mintza zeharkatzeko erraztasunaren arabera ekarpen ezberdina egingo diola potentzialari. Potasioa iragazkorrena izango da, eta horregatik atseden potentziala bere oreka potentzialetik hurbilen egongo da. Kloroa normalean ez da kontuan hartzen potentzialaren arabera mugitzen delako, garraio aktiborik gabe, iragazkortasun nahiko handiarekin. Ekuazio hau Nernst-Planck ekuaziotik abiatuta ere lor daiteke, hartuta eta integratuz. [4]
Funtsean, ekuazio honek bizirik dagoen zelula baten mintzean sortzen den potentziala adierazten du mintza zeharkatu dezaketen ioien menpe.
Funtzioak[aldatu | aldatu iturburu kodea]
Mintz potentziala ezinbestekoa da zelulen hainbat aktibitate burutu ahal izateko:
Kogarraioa[aldatu | aldatu iturburu kodea]
Sodioi ioien kontzentrazio ezberdintasuna zelularen barne eta kanpoaldearen artean kogarraioa ahalbidetzen du: Sodio ioi bat sartuko da gradientearen alde, eta beste molekula bat sartuaraziko du gradientearen kontra. Sartzen den molekula honen adibide garrantzitsuena azukre molekula da. Garraio mota honi bigarren mailako garraio aktiboa deritzo. Zuzenean ez da energiarik erabiltzen, baina zelulara sartutako sodio ioia berriz ateratzeko sodio potasio ponpa erabiltzen da, eta honek ATP erabiltzen du.
Energia ekoizpena[aldatu | aldatu iturburu kodea]
Zelulen mitokondrioek mintz potentziala erabiltzen dute energia ekoizteko, ATP molekulak sortzeko.
Ekintza potentziala[aldatu | aldatu iturburu kodea]
Mintz potentzialaren aldaketak informazio garraioa ere ahalbidetzen du. Neurona bati estimulu bat iristean, mintzaren potentziala aldatuko da. Estimuluak despolarizazio nahikoa eragiten badu ekintza potentziala sortuko da, eta neuronaren axoi guztian zehar garraiatuko da. Dena edo ezer ez motako erantzuna da. Despolarizazio batek kono axonikoan atari potentziala gainditzen badu, sodioaren boltai menpeko kanalak irekiko dira eta despolarizazio azkarra emango da. Puntu batera iristean sodio kanalak inaktibatuko dira (inaktibazio atea itxiz), hau inbertsio puntua izango da. Momentu honetan potasio kanalak irekitzen hasten dira (motelagoak dira irekitzen), eta mintzaren birpolarizazioa hasten da, potasioaren irteerarengatik. Potasio kanalak itxiko dira atseden potentziala berreskuratzean. Ixteko ere motelak direnez mintza hiperpolarizatuko da pixka bat atseden potentziala lortu aurretik.
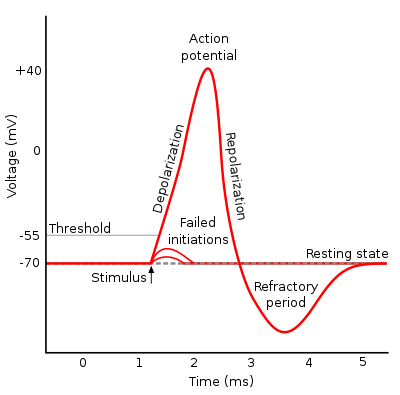
Inaktibatutako sodio boltai menpeko kanalak gutxinaka aktibatuz joango dira (inaktibazio atea irekiz), beste despolarizazio bat iristerakoan ireki ahal izateko. Inaktibazio epe hau oso garrantzitsua da despolarizazioa norabide batean garraiatzeko soilik, atzera ez joateko eta hainbat kitzikapen aldi berean iritsiz gero ekintza potentzial osoa eman dadin beste batekin hasi aurretik. Epe honi aldi errefraktorio deitzen zaio.
Bestetik, zelula barnean pilatutako sodio guztia kanporatu beharko da, eta horretaz ponpa arduratzen da.
Potasio boltai menpeko kanala irekiko ez balitz, toxinaren batengatik adibidez, mintzaren birpolarizazioa gertatuko litzateke, baina askoz motelagoa, soilik sodio potasio ponparen eraginez. Sodio boltai menpeko kanalak ez badira irekitzen ez da ekintza potentzialik jazoko, mintza ezingo baita despolarizatu, eta ezingo da informazioa garraiatu. Honek nerbio sistemaren arazo larriak eragingo lituzke, eta ondorioz, gorputzaren beste ataletan ere.
Muskuluaren uzkurdura[aldatu | aldatu iturburu kodea]
Muskuluaren uzkurdurarako ere mintz potentziala eta ioien garraioa ezinbestekoa da. Nerbioak garraiatutako ekintza potentzialak azetilkolinaren askapena eragingo du. Honek muskulu zelulako mintzako azetilkolinaren menpeko kanalak irekiko ditu, eta honen ondorioz sodio ioiak zelulan sartuko dira. Sodioaren sarrerak mintzaren despolarizazioa ekarriko du. Honek erretikulu sarkoplasmatikoan metatutako kaltzio ioien askapena bultzatuko du zitoplasmara, kaltzioaren boltai menpeko kanalen irekieragatik. Kaltzio honen sarreraren ondorioz uzkurketa gertatuko da. Amaitzeko atseden egoera lortuko da kaltzio ioiak erretikulu sarkoplasmatikora ponpatuz.
Zelulen funtzionamenduan eragina[aldatu | aldatu iturburu kodea]
Mintz potentzialaren aldaketa txikiek makrofagoetan, zelula ziliatuetan edo guruin zelulen barneko hainbat prozesu pizten dituzte.
Erreferentziak[aldatu | aldatu iturburu kodea]
- ↑ a b Philip Nelson, "Fisica Biologica, energia información, vida", 2005, Reverte editoriala
- ↑ Brian L. Silver, "The Physical Chemistry of membranes", 1985, The Solomon Press
- ↑ Arthur C. Guyton and John E. Hall, Texbook of Medical Physiology, 11th edition, Elsevier Saunders, 2006
- ↑ Michael E. Starzak, "The Physical Chemistry of membranes", 1984, Academic Press, Inc. (Harcourt Brace Jovanovich, Publishers)




























![{\displaystyle \lambda _{D}=\left[{\frac {2e^{2}c_{\infty }}{K_{B}T\epsilon }}\right]^{-1/2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cf2cc329a9d241943f5a39532bd1f7859610f8cf)





























![{\displaystyle J=D\left[-{\frac {dc}{dx}}+{\frac {cqE}{K_{b}T}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1f5173420720cdf4cfed042d025a9798ac5b64cb)









































































