Buteno
| Buteno | |
|---|---|
| Formula kimikoa | C4H8 |
| Konposizioa | karbono eta hidrogeno |
| Mota | alkeno |
| Masa molekularra | 56,11 g/mol |
| Identifikatzaileak | |
| CAS zenbakia | 25167-67-3 |
| ZVG | 510089 |
| EC zenbakia | 246-689-3 |
| ECHA | 100.042.430 |
Butenoa edo Butilenoa alkeno bat da, C4H8 formula kimikoa duena. Zehazki, formula horixe duten alkeno isomeroei izen hori ematen zaie, zenbait bereizgarrirekin batera. 1825ean aurkitu zen lehen aldiz butenoa, Michael Faraday zientzialariari esker, gasaren olioan aurkitu zuen.
Lau konposatu isomerok dute formula kimiko bera:
- 1-butenoa: CH2=CH–CH2–CH3
- 2-butenoa: H3C–CH=CH–CH3. Cis eta trans isomeroak ditu eta haien arteko desberdintasuna metiloek duten norabidean dago, izan ere, cis isomeroan metiloek norabide bera dute, baina trans isomeroan aurkako norabideak dituzte (ez dezagun ahaztu lotura bikoitzeko bi atomoak eta beraien 4 ordezkatzaileak oinarri berean daudela).
- 2-metilpropenoa edo isobutilenoa: H2C=C(CH3)2.
Lau isomeroak koloregabeko gasak dira eta sukoiak ere badira, gar hori bat sortzen baitute errekuntza erreakzioetan. Airearekin nahasketa lehergarriak sor ditzakete eta presio baxuan zukutuak izan daitezke.
Bromo elementalarekin edo potasio permanganatoaren (KMnO4) tankerako disoluzio azidoekin erraz erreakzionatzen dute. Bestalde, petroliotik abiatuta, cracking erreakzioen bidez lor daitezke.
Amankomunean dituzten zehaztapenak[aldatu | aldatu iturburu kodea]
- Formula: C4H8
- Masa molekularra: 56,11 g/mol
- Lehergarritasun mugak: % 1,6 - 10 Vol airean
Zehaztapenak isomeroka[aldatu | aldatu iturburu kodea]
Taula honetan isomero bakoitzaren irudikapena eta egitura azaltzen da:
| IUPAC izena | Izen arrunta | Egitura | Bizkarrezur-formula | 3D eredua |
|---|---|---|---|---|
| but-1-enoa | 1-butilenoa | 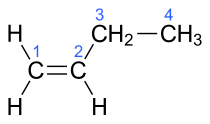
|

| |
| Cis-but-2-enoa | Z-β-butilenoa | 
|

|

|
| Trans-but-2-enoa | E-β-butilenoa | 
|

|
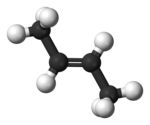
|
| 2-metilpropenoa | Isobutilenoa | 
|

|

|
1-butenoa[aldatu | aldatu iturburu kodea]
- Formula: CH2=CH–CH2–CH3
- Urtze-puntua: –185,3 °C
- Irakite-puntua: –6,26 °C
- Disolbagarritasuna uretan: 200 g/l
- CAS Zb.: 00106-98-9
Sintesiari dagokionean, petrolioaren termolisiaren bidez lor daitekeen arren, etilenoa eta tris-etilaluminoa erreakzionarazten baditugu, gutxi gorabehera, 100 °C-tan eta 100 bar-eko presioan ere eskuratuko genuke 1-butenoa, Mülheimerren 1-alkenoen sintesiaren arabera. Erreakzio hori Ziegler-Nata katalizatzaileen bidezko polietilenoaren sintesiarekin aldera daiteke.
1-butenoa kautxu artifiziala ekoizteko erabiltzen da nagusiki, baina 2-glutanolaren sintesian hasiera-produktu gisa ere baliatzen da, aipatutako konposatua uraren adizioa baliatuz lortu nahi bada, ingurune azido batean betiere.
2-butenoa[aldatu | aldatu iturburu kodea]
Cis-2-butenoaren datu kimikoak:
- Formula: CH3–CH=CH–CH3
- Urtze-puntua: –138,9 °C
- Irakite-puntua: 3,73 °C
- Disolbagarritasuna uretan: 5 g/l
- CAS Zb.: 00590-18-1
Trans-2-butenoaren datu kimikoak:
- Urtze-puntua: –105,5 °C
- Irakite-puntua: 0,96 °C
- Disolbagarritasuna uretan: 5 g/l
- CAS Zb.: 00624-64-6
2-butenoa lortzeko propenotik abia gaitezke eta metatesi erreakzio bat martxan jarri, katalizatzaile baten presentzian:
Petrolioaren pirolisiaren bidez ere eskura daiteke konposatua. Bestalde, 2-butanoletik abiatutako eliminazio-erreakzioek produktuen nahasketak eman ohi dituzte emaitzatzat, batzuetan, 2-butenoarekin batera.
Arras aipagarria da trans-butenoa cis-butenoa baino 5,4 kJ/mol egonkorragoa dela, metilo taldeen alborapen esterikoa dela eta. Infragorrien espektroskopian trans isomeroak 960 970 cm-1 gunean xurgapen-banda bat du, zis isomeroan ez dena ageri. Bi isomeroen arteko interbihurtze langa 250 kJ/mol-ekoa da. Beraz, giro-tenperaturan ez dira interbihurtzen.
Erabilerari dagokionean, isomero honi kloroaren halogenazio-erreakzioa gauzatzen bazaio eta ondoren, HCl-arekin eliminazio bikoitza egiten bazaio, butadienoa eskuratzen da, kautxu artifizialaren sintesian oso erabilia. Gainerako butenoak bezala, zuzenean polimerizatua izan daiteke.
Isobutilenoa[aldatu | aldatu iturburu kodea]
- Formula: H2C=C-(CH3)2
- Urtze-puntua: –140,4 °C
- Irakite-puntua: –6,9 °C
- Disolbagarritasuna uretan: ? g/l
- CAS Zb.: 115-11-7
Petrolioaren pirolisia egitean askatzen diren gasetatik eskura daiteke, era industrialean. Laborategian aldiz, eliminazio erreakzioak martxan jarriz eskura dezakegu.
Erreaktibotasunari dagokionean, Markovnikoven adizioan (adibidez, ingurune azido batean) iso-butenoak 2(-2-metilpropil) (= tert-butil) taldeekin eratorriak ematen ditu. Beraz, uraren adizioak azido sulfurikoaren presentzian tert-butanola ematen du eta alkoholen adizioak tert-butil eterrak ematen ditu. Azken hauek garrantzia hartu duten gasolinaren gehigarri gisa, izan ere, erregaiaren oktano kopurua areagotzen dute. Karbono monoxidoarekin erreakzionaraziz gero, azido sulfurikoaren presentzian, azido pibalikoa ((H3C)3C–CO2H) sortzen da.

