Kiralitate (kimika)
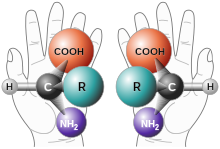
Kiralitatea ispilu-irudiarekin gainjartzeko ezintasunean datzan objektuen propietatea da. Adibidez, gizakion ezkerreko eskua ezin da gainjarri bere ispìlu-irudia den eskuineko eskuarekin. Bestelakoak dira kuboak edo esferak, beren ispilu-irudiarekin gainjar baitaitezke.
Oro har, objektu kiralek ez dute errotazio-ardatz desegokirik. Izanez gero, haien ispilu-irudiak gainjarriak dira.
Kimika organikoko, kimika ez-organikoko eta biokimikako propietate bat da, zeinaren ondorioz gertatzen diren estereokimika, erreakzio estereoespezifikoak eta estereoisomeroak. Enantiomero edo isomero optiko deritze molekula kiral baten bi irudi espekularrei edo ispilu-irudiei.
Definizio horrek ezaugarri geometriko eta dikotomikotzat hartzen du kiralitatea. Ezaugarri geometrikotzat hartzen duela esan daiteke, zeren eta irudi geometrikoetan edo puntu-multzoetan simetria-eragiketak (islapenak) aplikatzean oinarritzen baita. Ezaugarri dikotomikotzat hartzen duela esan daiteke, ordea, ispilu-irudiak txandakatzeen eta translazioen bidez gainjarriak izan daitezkeelako (ez kiralak), edo gainjarezinak (kiralak). Ikuspegi klasikotik ez dago erdibiderik.
Aminoazidoak, karbohidratoak, azido nukleikoak eta beste molekula batzuk farmako askoren eta gure gorputzeko molekula ia guztien parte dira. Esan beharra dago kiralitate molekularrak ahalbidetzen dituela entzimen eta organismoaren substratuen arteko interakzio espezifikoak, biziaren oinarria diren erreakzio kimikoetan parte hartzen dutenak.
Kiralitatearen jatorriak[aldatu | aldatu iturburu kodea]
Molekula organiko baten kiralitatearen kausarik ohikoena da sp3 hibridazioa duen eta 4 ordezkatzaile desberdinei lotuta dagoen karbono tetraedrikoko atomo baten presentzia. Egun, zentro kiral esaten zaie karbono horiei, baina beste termino batzuk ere erabili dira, besteak beste, estereozentroa edo zentro estereogenikoa. Zentro kirala kiralitatearen kausa da, baina kiralitatea molekula osoak duen propietatea da.[1]
Molekula batzuek zentro kiral bat dute, baina molekula akiralak dira. Molekulak zentro kiral bakarra duela ondorioztatzen bada, molekula kiral bat dela ziurta daiteke. Zentro kirala egoteak edo ez egoteak baldintzatuko du kiralitate-irizpidea.
Aipatutako kiralitatea kiralitate puntuala da, guztietatik ohikoena. Horrez gain, kiralitate axiala eta planarra ere badaude, molekulei aktibitate optikoa ematen dieten fenomenoak.
Aktibitate optikoa[aldatu | aldatu iturburu kodea]
Argi ikusgaiak plano guztietan oszilatzeko joera du. Iragazki polarizatzaile batetik igarotzean, polarizatutako argiak plano bakar batean oszilatzen du. Molekula kiralek argi polarizatuaren planoa angelu jakin bat desbideratzeko (biratzeko) propietatea dute. Argia eskuinerantz biratuz gero, dextrogiro edo (+) deritze. Berriz, argi-planoa ezkerrerantz desbideratzen badute, aldiz, levogiro edo (-) esaten zaie.
Errotazio optikoaren angelua Jean Baptiste Biot fisikari frantsesak aztertu zuen lehen aldiz. Berak aurkituriko legeak bere izena darama eta honakoa adierazten du optikoki aktiboa den konposatu batentzat:
non:
- biraketa optikoaren angelua den, radianetan.
- errotazio-ahalmen optiko espezifikoa den, rad·m2·kg-1-etan, Celsius tenperatura eta uhin-luzera izanik.
- dentsitatea den, kg·m-3-etan.
- bide optikoaren luzera izanik, m-etan.
Adierazpen baliokide bat hurrengoa da:
non:
- errotazio-ahalmen optiko molarra den, rad·m2·mol-1-tan.
- kontzentrazioa den, mol·m-3-tan.
Errotazio-ahalmen optikoa (espezifikoa edo molarra izan) substantzia bakoitzaren konstante bereizgarria eta uhin-luzeraren funtzioa da.
Normalean, bibliografian sodioaren (horia) D lerroa aipatzen da 25 °C-ko tenperaturaren erreferentzia gisa. Zenbakizko balioa berdina da enantiomero-pare bakoitzarentzat, dextrogiroak balio positiboa hartzen du eta levogiroak, berriz, balio negatiboa. Elkarrekin, enantiomero bakoitzaren kontzentrazio berdinak dituen disoluzio batean, (nahaste errazemikoa deiturikoa), zeinuak bata besteari ezeztatzen zaizkio zeroko balio birakaria emanez.
Argi polarizatuaren sorta batek molekula indibidual bat zeharkatzen duenean, zeharkatzen duen molekula bakoitzeko beste bat dago, berdin-berdina, lehenengoaren ispilu-irudi gisa orientatua, eta horrek efektua erabat deuseztatzen du. Guzti hau konposatu gehienak argi polarizatua biratzeko gai ez diren arren. Efektu honen emaitza aktibitate optikoa da. Enantiomero puru batean, molekulak ezin du beste baten ispilu-irudi aurkitu, ondorioz, ez dago errotazioen deuseztapenik eta aktibitate optikoa sortzen da.
Zentro kiral baten konfigurazioaren determinazioa[aldatu | aldatu iturburu kodea]
Zentro kiral bat R edo S den zehazteko, CIP (Cahn-Ingold-Prelog) sekuentzia-araua aplikatu behar da, eta, horrekin batera, zuzenean zentro kiralari lotutako atomoen edo taldeen lehentasun-ordena ezarri. Orden hori ezartzeko, lau talde edo atomoetako bakoitzari garrantzi-zenbaki bat esleitzen zaio, sekuentzia-arauen arabera. Talde edo atomo horien lehentasuna ezartzeko, molekula behatu behar da, zenbaki atomiko txikiena duen taldea behatzailearengandik urruntzeko asmoz. Lehen planoan agertzen diren atomoek triangelu bat osatzen dute. Garrantzitsua da jakitea behin taldeei lehentasuna eman zaienean, lehentasun-ordenak ezarritako biraketa-noranzkoa erlojuaren orratzen noranzkoa bada, zentroa R dela (latinetik rectus, eskuinekoa) eta kontrako noranzkoa S dela (latinetik sinister, ezkerrekoa).
Lehentasun-ordena ezartzea ahalbidetzen duten arauak:

- Zentro kiralari lotutako taldeen lehentasun-ordena zentroari lotutako atomoen kopuru atomikoaren arabera ezarri behar da, zenbaki atomikoa handiagoa bada, lehentasuna izango duela kontuan hartuta.
- Zentro kiralari lotutako bi atomo edo gehiago berdinak badira, atomo elkartuen zenbaki atomikora jo behar da. Guzti hori, baliokidetasuna errepikatzen den aldietan egin behar da.
- Zentro kiralak elektroi pare bat badu, zeroko zenbaki atomikoa eman dakioke.
- Lotura anizkoitzetan, atomoak bikoiztutzat (linealtzat) hartu behar dira. Bi isotopo kiral erdiguneari lotuta daudenean, pisu molekular handiagoa duenak ezarriko du lehentasuna bestearekiko. [2]
Kiralitatearen garrantzia aktibitate biologikoan[aldatu | aldatu iturburu kodea]
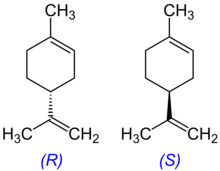
Maila molekularrean, asimetria prozesu biologiko gehienetan dago, eta, beraz, kiralitatea oso garrantzitsua da jarduera biologikoaren testuinguruan. Hala ere, kiralitatea ez da baldintza bat molekula bioaktiboek beren jarduerak egin ditzaten. Zentro estereogeniko bat dagoen tokian alde handiak ikusten dira enantiomeroen jardueretan. Fenomeno hori substantzia bioaktiboetan ikusten da, hala nola, intsektizidak, sendagaiak edota herbizidak.
Hartzaileen eta entzimen funtzioa edozein dela ere, komunean dute molekula kiralak direla, eta horrek enantioselektiboak izatea eragiten du, neurotransmisoreak eta hormonak bezalako molekula mezulariekin batera.
Arau bat aurkeztu zen, farmako errazemiko baten dosia zenbat eta txikiagoa izan, orduan eta handiagoa izango dela jarduera farmakologikoaren eta isomero optikoen arteko aldea. Konfigurazio egokia duten molekulak, hartzailearen gune aktibora egokitu ahal izango dira; beraz, molekula zenbat eta hobeto doitu, orduan eta hobea izango da farmakoa.[3]
Erreferentziak[aldatu | aldatu iturburu kodea]
- ↑ «BIBLIOGRAFÍA» Introducción a la Química Orgánica (Programa Editorial Universidad del Valle): 215–215. 2012-10-26 (Noiz kontsultatua: 2023-11-03).
- ↑ «Grupos funcionales y nomenclatura» Química orgánica: ejercicios de aplicación (Editorial Utadeo): 43–90. 2011-12-28 (Noiz kontsultatua: 2023-11-03).
- ↑ Pereira Fariña, Martín. (2018-11-28). «TRILLAS, Enric: El desafío de la creatividad, Universidade de Santiago de Compostela, Servizo de Publicacións e Intercambio Científico, Santiago de Compostela, 2018, 286p.» Agora: papeles de Filosofía 38 (1) doi:. ISSN 2174-3347. (Noiz kontsultatua: 2023-11-03).

![{\displaystyle \alpha =[\alpha ]_{\lambda }^{\theta }\rho l}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aba80b37369cda79891963acf5c30d1c4de27800)

![{\displaystyle [\alpha ]_{\lambda }^{\theta }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5fd7c2179679e123136e6c2ac86c2400066a34e)






