Lotura kimiko

Lotura kimikoa atomo eta molekulen arteko interakzio erakargarrien prozesu kimikoaren erantzulea da. Halaber, konposatu kimiko diatomiko eta poliatomikoei egonkortasuna ematearen erantzulea da. Indar erakargarri horien azalpena kimika kuantikoaren legeetan aurkitzen dugu.[1]
Lotura kimikoa azaltzeko era sinpleago bat honakoa da: lotura kimikoa bi atomoren arteko indarra da behin sistema egonkorrago bat eratu eta gero.[2] Molekula, kristal, metal eta gas diatomikoak lotura kimikoen bidez elkartuta daude, eta materiaren propietate fisiko eta kimikoak determinatzen dituzte.
Aurkako kargak elkar erakartzen dute elkarturik daudenean egoera egonkor bat eratzen dutelako banatuak zeudenean baino. Atomoen kasuan, egonkortasun handieneko egoera nukleotik urrunen dagoen geruzan zortzi elektroi aurkitzen direnean lortzen da. Hau gas nobleen kasua da.
Lotura kimikoaren teoria[aldatu | aldatu iturburu kodea]
Lotura kobalentean, bi elektroi nukleo atomikoen arteko espazioan kokatzen dira. Bertan, bi nukleoen karga positiboek negatiboki kargatutako elektroiak erakarriko dituzte, nukleo bakoitzak bere elektroiak erakarri beharrean. Honek, positiboki kargaturiko bi nukleoen arteko errepultsioari aurre egiten dio. Hain da erakarpen handia, ezen honek nukleoak oreka-konfigurazio egonkor batean mantentzen dituen, oreka-posizioan bibratzen jarraituko duten arren.
Laburbilduz, lotura kobalente batean positiboki kargaturiko nukleoek negatiboki kargaturiko elektroiak erakartzen dituzte eta horrela elektroiak partekatzen dituzte.
Lotura ionikoan, ez da elektroirik partekatzen loturan, baizik eta transferitu egiten da. Lotura mota honetan, nukleotik urrunen dagoen orbital atomikoak espazio libre bat dauka elektroi bat edo gehiagoren gehikuntza ahalbidetzen duena. Ondorioz, nukleo batek beste nukleo bati elektroia “kentzen” diola esan dezakegu. Transferentzia honek nukleo batek karga neto positiboa izatea eta beste nukleoak karga neto negatiboa izatea eragiten du. Horrenbestez, lotura atomoen arteko erakarpen elektrostatikoaren ondorioz sortzen da, eta atomoak karga positibo eta karga negatiboko ioiak bihurtzen dira.
Lotura guztiak teoria kuantikoaren bidez azalduak izan daitezke, baina praktikan teoria edo arauak erabiltzen dira loturaren indarra, noranzkoa eta polartasuna aurresateko. Adibide modura, zortzikotearen araua eta balentzia-geruzaren elektroi-bikotearen aldapenaren teoria ditugu.
Teoria garatuagoak ere badira, balentzia loturaren teoria adibidez, orbitalen hibridazioa eta erresonantzia barne hartzen dituena.
Lotura kimikoaren historia[aldatu | aldatu iturburu kodea]
XII. mendean hasi ziren lotura kimikoari buruzko lehengo espekulazioak egiten. Garai hartan jada susmoa zuten espezie kimiko batzuk haien artean elkarturik zeudela afinitate kimiko mota baten bidez.
1704an, Isaac Newtonek lotura atomikoaren teoria azaldu zuen, teoria horrek esaten zuen atomoak elkarri lotuak zeudela indar jakin baten ondorioz . Hainbat teoria ikertu zituen, teoria hauek atomoak haien artean nola elkartu zitezkeen azaltzen zuten. Teoria horien adibide bat honakoa zen: “elkarri itsatsiriko atomoak geldialdiaren ondorioz”. Newtonek honakoa ondorioztatu zuen:
Partikulak elkar erakartzen dute indar batengatik, indar hori oso handia da eta masarekiko zuzenki proportzionala da eta distantziarekiko alderantzizko proportzionala da. Distantzia txikietan partikulak operazio kimikoak gauzatzen dituzte.
1819an, pila voltaikoaren asmakizunaren ondorioz, Jöns Jakob Berzeliusek konbinazio kimikoaren teoria bat garatu zuen. Teoria horretan atomoen izaera elektropositibo eta elektronegatiboak sartu zituen zeharka. XIX. mendearen erdialdean, Edward Frankland, F. A. Kekule, A. S. Couper, A. M. Butlerov eta Hermann Kolbek erradikalen teoria zabaldu zuten eta balentzia teoria eratu zuten. Teoria horrek azaltzen zuen konposatuak elkarturik mantentzen zirela erakarpen positibo eta negatiboaren eraginez. 1916an, Gilbert N. Lewisek elektroi-bikotearen lotura kontzeptua adierazi zuen, elektroi-bikotearen lotura kontzeptuak honakoa adierazten du: bi atomok elektroi bakarretik sei elektroira bitartean partekatu ahal dituzte, eta elektroi bakarreko lotura, lotura bakuna, lotura bikoitza edo lotura hirukoitza eratu ahal dituzte.
Lewis-en hitzetan:
| « | Elektroi bat bi atomo ezberdinen geruzen parte izan daiteke eta ezin dugu esan elektroia atomo batena edo bestearena denik. | » |
Urte berean, Walther Kossel-ek Lewis-en antzeko teoria bat atera zuen; ezberdintasuna honakoa zen: Walther-ek atomoen artean erabateko elektroi transferentzia gertatzen zela adierazten zuen, lotura ioniko baten eredua hain zuzen ere.
1927an, Oyvind Burrau fisikari daniarrak matematikoki guztiz osorik zegoen lotura kimiko bakun baten lehenengo deskripzio kuantikoa egin zuen. Lotura kimiko bakun hori molekularen elektroiarena zen[3]. Lan honek erakutsi zuen nola lotura kimikoentzat hurbilketa kuantikoak zuzenak izan zitezkeen kualitatiboki, baina matematikoki ezin izango zen zehaztu elektroi bat baino gehiagoko molekulentzat. Urte berean, Walter Heitler eta Fritz Londonek hurbilketa praktikoago bat argitaratu zuten. Hala ere, hurbilketa hori ez zen hain kuantitatiboa. Heitler-London metodoa gaur egun ezagutzen dugun balentzia-loturaren teoriaren oinarria da. 1929an, John Lennard-Jones orbital atomikoen konbinazio linealaren metodoa eratu zuen, printzipio kuantiko basikoetatik abiatuz. Orbital molekularraren teoria honek lotura kobalentea orbital atomikoen konbinazioen ondorioz sortutako orbital bat zela adierazi zuen.
1929an, John Lennard-Jonesek orbital atomikoen konbinazio linealen metodoa aurkitu zuen. Fluor molekularen eta oxigeno molekularen estruktura atomikoak lortzeko metodoak ere lortu zituen printzipio kuantikoetatik abiatuta.
Orbital molekularraren teoria honek lotura kobalentea honela deskribatzen zuen: elektroi bakarreko atomoetatik hipotetizaturiko Schrodingerren mekanika kuantikotik deskribaturiko orbital atomikoen konbinaziotik eratzen ziren orbital molekularrak, lotura kobalentea eratuz.
Atomo multielektronikoentzako ezin dira lotura eratzen duten elektroien ekuazioak zehaztasun matematiko batekin eman, baina hurbilketak erabiltzen jarraitzen dira, hainbat aurresate eta emaitza kualitatibo onak ematen baitituzte. Kimika kuantiko modernoan kalkulu kuantitatibo asko egiteko, orbital molekularren teoria edo balentzia-loturaren teoriak erabiltzen dituzte abiapuntu. Hala ere, hirugarren hurbilketa bat garrantzia hartzen ari da azkenengo urteetan, dentsitate funtzionalaren teoria, hain zuzen ere.
1935ean, H. H. James eta A. S. Coolidgek hidrogeno molekularen kalkulu bat aurrera eraman zuten. Kalkulu hau gainerako kalkuluetatik ezberdintzen zen. Gainerako kalkuluek elektroien eta nukleoen arteko distantziarentzako funtzioak soilik erabiltzen zituzten. Honakoak, aldiz, bi elektroien arteko distantzia soilik hartzen zuen kontuan[4]. 13 parametro doigarrirekin, lotura-disoziazioaren energia emaitza esperimentalaren emaitza oso antzeko bat lortzen zuten. Aurrerago, 54 parametro erabili ziren eta konkordantzia handia erakutsi zuten esperimentuekiko. Hala ere, hurbilketa honek ez du erlazio fisikorik balentzia-lotura teoriarekin, ezta orbital molekularren teoriarekin ere, eta zaila da hurbilketa hau molekula handientzako erabiltzea.
Balentzia Loturaren Teoria[aldatu | aldatu iturburu kodea]
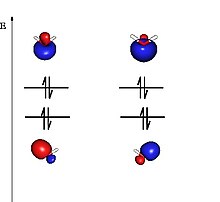
Balentzia Loturaren Teoria, Kimikan, Orbital Molekularren Teoriarekin batera, mekanika kuantikoaren
Balentzia Loturaren Teoriaren arabera, molekularen elektroiak atomo indibidualen orbitaletan daude kokatuta, hau da, lotura kimikoa osatzen duten balentziazko bi elektroiak beraien orbital atomikoetan daudela kokatuta, hots, atomo desberdinen bi orbital erdibeteren gainezarpena da, spin antiparaleloak dituzten elektroiak bikote bilakatuaz.
1939an, Linus Pauling kimikariak, 6 arau aurkeztu zituen elektroi partekatu horientzat (azken hiru arauak txertatu zituen) nahiz eta lehenengo hirurak ezagunak ziren lehendik:
- Bi elektroiren arteko lotura, elektroi desparekatuaren interakziotik sortzen da.
- Loturan parte hartzen duten elektroiek aurkako spin-a izan behar dute.
- Behin lotura osatuta, bi elektroi horiek ezin dute beste loturetan parte hartu.
- Atomoetako loturetako elektroiek funtzio bakarra dute.
- Energia gutxieneko elektroi libreak lotura sendoenak osatzen dituzte.
- Atomo bateko bi orbitaletako batek beste atomo bateko orbital batekin gainazarmen handieneko lotura osatuko du, lotura hau zentratuago egonik orbital kontzentratuenera.
Orbital Molekularraren Teoria[aldatu | aldatu iturburu kodea]

Orbital Molekularren Teoria (OM), elektroiak ondoan dauden atomoen arteko lotura bakar bati egokituta egon beharrean, molekula guztiaren nukleo atomikoen eraginpean mugitzen direla adierazten duen hurbilketa bat da. Hurbilketa honen arabera, atomoen izaera galdu egiten da molekularen izaeraren barruan. Hurbilketa hau lotura kimikoa determinatzeko erabiltzen da. Molekulen propietate espazial eta elektronikoak mekanika kuantikoari esker daude antolatuta, eta horrela, teoria honen arabera, molekuletan osatzen diren orbitalak molekula osoan zehar deslokalizatuta daude, ez balentzia loturan (BL) teorian bezala, hau da, bi atomoen artean lokalizatuta.
Orbital atomikoek atomo bati dagozkion elektroiak deskribatzen dituzte eta orbital molekularrek, molekula batean dauden elektroiak, goran aipatu bezala, molekula guztian zehar deslokalizatuta egon daitezkeelarik. Orbital molekularren teoriak, XX. mendearen hasieran proposatu zen, loturen ikerketa goitik behera aldatu zuen lotutako elektroien posizioak -orbital molekularrak- orbital atomikoen konbinazio lineal bezala aurkeztu zituenean. Orbital molekularren (OM) teoriak orbital atomikoen konbinazio linealak erabiltzen ditu orbital molekularrak eratzeko. Honetan, atomoek elkarren artean loturak eratzen dituzte. Hiru mota ezagutzen dira: orbital lotzaileak, orbital antilotzaileak eta orbital ez-lotzaileak. Orbital lotzaileetan, elektroi-dentsitatea bi atomoen arteko zonaldean kontzentratzen da; beraz, dentsitate elektroniko honek bi nukleoen erakarpena eragingo du, bi atomoak batera mantenduaz. Orbital antilotzaileek aldiz, elektroi-dentsitatea nukleo bakoitzaren atzean kontzentratzen dute, hau da, beste atomotik urrunen dagoen atomoaren aldean. Era honetan, elektroi dentsitateak nukleoa erakartzean, bi atomoen distantzia handituko du, hauen arteko lotura ahulagoa eginez. Orbital ez-lotzaileko elektroiek ez dute elkar eragiten positiboki edo negatiboki orbital atomikoetan, beraz, ez dituzte loturak ahultzen edo sendotzen.
Orbital molekularrak azken hauek osatzen dituzten orbital atomikoen araberakoak dira. Sustantzia kimikoek lotura interakzioak eratuko dituzte, azken hauen orbitalen energia txikiagoa bihurtzen bada interakzioak izaterakoan. Loturak dituzten orbital desberdinak daude, konfigurazio elektronikoaren (elektroi-hodei) eta energia mailaren arabera.
Balentzia Loturaren Teoriaren eta Orbital Molekularraren Teoriaren arteko konparaketa[aldatu | aldatu iturburu kodea]
Balentzia Loturaren Teoria eta Orbital Molekularraren Teoria elkar konparatzen dira bata bestearekin, izan ere, molekula sinple bat badugu, errazago hurbiltzen da elektroiak lotura horretan duten portaera aztertzera, horretarako Balentzia Loturaren Teoria erabiliz; aldiz, molekula handia bada, orbital molekularretako elektroien portaera aztertzen da, lotura kimiko horren ezaugarri garrantzitsuak aurresanez.
Hau da, lehen aipatu bezala, Balentzia Loturaren Teoriak, molekularen elektroiak atomo indibidualen orbitaletan daudela kokatuta dio, eta aldiz, Orbital Molekularraren Teoriak, molekula batean dauden elektroiak deskribatzen ditu, molekula guztian zehar deslokalizatuta egon daitezkeelarik. Beraz, honetan datza konparaketak: lehenengo teoriak atomoen arteko elektroiak aztertzen ditu, eta, aldiz, bigarren teoriak molekula guztian zehar deslokalizatuta egon daitezkeen elektroiak aztertzen ditu.
Lotura kimiko motak[aldatu | aldatu iturburu kodea]
Molekuletan atomoak lotuta mantentzen dituzten loturak indar intramolekularrak dira.
Loturak elektroiak interakzionatzeko modu desberdinak dira, sistemaren ezaugarrien arabera. Hiru lotura mota daude, eta normalean lotura eredu batek baino gehiagok parte hartzen dute.

Lotura kobalentea[aldatu | aldatu iturburu kodea]
Lotura kobalentea atomoen arteko elektroien elkarbanaketan oinarritzen da. Elektroi horiek bi nukleoak lotuta mantentzen dituzte. Lotura osatu aurretik, elektroiak atomo isolatuak dira eta behin lotura osatzen denean, berriz, bereiztezinak dira; hau da, sistemarenak.
Lotura kobalenteak sinpleak izan daitezke, elektroi-bikote bat partekatzen denean (H - H), bikoitzak, bi-elektroi bikote partekatzen direnean (O = O), hirukoitzak, hiru elektroi-bikote partekatzen badira edo laukoitzak, lau elektroi-bikote partekatzen badira.
Lotura kobalentea bi atomo berdinen artean bada, lotura apolarra da. Molekula hauetan elektronegatibotasun-diferentzia zero da, eta atomo berdinez osatuta dagoenez lotura, molekula mononuklearra dela esaten da. Bi atomo desberdinek osatzen badute lotura, eta elektronegatibotasunean desberdintasun handia baldin badago, orduan lotura polarra da; hau da, loturaren muturretako bat elektropositiboa da, dentsitate elektroniko positiboa du, eta beste muturra, berriz, elektronegatiboa. Hala ere, molekula neutroa izaten jarraituko du. Lotura kobalente polarra lotura kobalentearen eta ionikoaren tartean aurkitzen da.
Loturan parte hartzen duten atomo horien izaeraren menpekoak dira lotura kobalentearen ezaugarriak.

Lotura ionikoa[aldatu | aldatu iturburu kodea]
Lotura ionikoa ioi positiboen eta negatiboen artean ematen den indar elektrostatikoaren emaitza da. Beste modu batean esanda, katioi eta anioi baten arteko lotura, hau da, elementu elektronegatiboenak elementu elektropositiboenaren elektroiak erakartzen dituenean. Elementu metalikoek balentzia-elektroi gutxi dituztenez, eta haien ionizazio-energia baxua denez, katioi bihurtzeko joera dute. Elementu ez-metalikoek, berriz, balentzia-elektroi asko dituzte, eta elektroiak hartzeko joera, hori dela eta, anioi bihurtzeko joera dute. Ioiek hiru dimentsioko sarea osatzen dute.
Ioi horiek era egonkorrean elkartzen dira lotura ionikoaren bidez, eta modu horretan konposatu ionikoak eratzen dira.
Adibidea:
Sodio eta kloroaren arteko lotura, lotura ionikoa da. Sodioak bere azkenengo geruzako elektroi bat galtzen du, eta kloroak irabazten du.
Na = elektroi bat galdu (katioi bihurtu)
Cl = elektroi bat irabazi (anioi bihurtu)
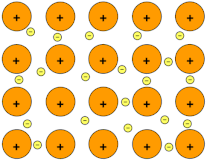
Lotura metalikoa[aldatu | aldatu iturburu kodea]
Lotura metalikoan parte hartzen duten elektroiak, elektroi-itsaso batean aurkitzen dira. Elektroi-itsaso mugikor hori metalen ezaugarri askoren erantzule da. Ezaugarri horiek ondorengoak dira: dentsitate altua daukate, orokorrean eroaleak dira, distira daukate, opakoak dira eta orokorrean xaflagarriak eta harikorrak dira. Gainera, gehienek fusio-puntu altuak dituzte.
Nahiz eta lotura metalikoa eta lotura ionikoa antzekoak izan, lehenengo lotura mota trinkoagoa da, izan ere lotura inguratzen duten atomo kopurua handiagoa da.
Gainera, konposatu ionikoetan elektroiak eta beraien kargak estatikoak dira kasu honetan ez bezala.
Molekularteko indarrak[aldatu | aldatu iturburu kodea]
Lotura kimikoaren ildotik jarraituz, molekularteko indarrei buruz hitz egitea beharrezkoa da. Indar hauei, indar intermolekular ere deritze. Hitzak berak esaten duen bezala, molekulak lotuta mantentzen dituzten indarrak dira, horretarako elkarrekintza elektronikoen beharrik gabe. Ez dira molekula baten barneko atomoak lotuta mantentzea eragiten duten indarrak, alegia. Indar hauek ez dira lotura kimikoak, baina oso garrantzitsua da horien existentziaz jabetzea. Gainera, lotura kimikoekin alderatuta oso ahulak dira.
Adibidez:
Uraren mol bat lurrintzeko (indar INTERmolekular)= 41KJ behar dira
Ur molekularen bi O-H loturak hausteko (indar INTRAmolekular)= 930 KJ.
Lehenengo kasuan indar intermolekularrei erreparatu behar zaie; bigarrenean,ordea, indar intramolekular edo lotura kimikoari.
Esan bezala, bi molekula edo gehiago lotuta mantentzen dituzten indarrak dira, eta hauen sendotasuna ez da beti berdina. Alegia, solidoen molekularteko indarrak eta gasen molekularteko indarrak sendotasun desberdina dute eta hori aztertzeko egoera fisiko bakoitzari erreparatu beharko zaio. Izan ere, solidoek izango dituzte molekularteko indarrik sendoenak eta gasek ,ordea, ahulenak. Likidoak tarteko egoera batean egongo dira. Hori dela eta, esan liteke indar hauek solidoetan eta likidoetan dutela eragin nagusia (gasetan ahulegiak baitira).
Indar intermolekularrek molekula askoren ezaugarri fisiko-kimikoetan eragina dute. Adibide garbia fusio- eta irakite-tenperaturarena litzakete. Alegia, kontuan izan behar da, irakite-tenperatura aztertzerako garaian indar inetrmolekularrei erreparatu behar zaiela eta ez intramolekularrei (molekula baten barneko loturak). Hau da, irakite-tenperatura aztertzeko, likido-egoeratik gas-egoerara igarotzeko prozesua aztertu behar da. Aldaketa fisiko hori gerta dadin, indar intermolekularrei erreparatzea ezinbestekoa da. Alegia, tenperatura igo ahala molekulak geroz eta gehiago bibratzen hasten dira eta horien arteko indar intermolekularrak apurtzen hasten dira. Beraz, indar intermolekular horien arabera, bero gehiago, alegia energia gehiago, edo gutxiago behar izango dugu likido-egoeratik gas-egoerara igarotzeko.
Molekularteko indarren artean, indar mota desberdinak bereizten dira polaritatearen ikuspuntutik begiratuta; orientazio-indarrak, indukzio-indarrak eta dispertsio-indarrak.[5]
Orientazio-indarrak[aldatu | aldatu iturburu kodea]

Dipolo-dipolo indar ere esaten zaie. Indar hauek molekula polarren artean sortzendira. Momentu dipolar iraunkorra dutenez, dipoloen arteko orientazioa gertatzen da, haien arteko erakartze elektroestatikoa gehiegizkoa izan dadin. Momentu dipolarra handitzen bada, indar intermolekular hauek ere handiagotuko dira.[6]
Likido eta gasetan gertatzen den orientazioa ez da solidoetan ematen dena bezain zurruna.
Hidrogeno-lotura[aldatu | aldatu iturburu kodea]
Dipolo-dipolo interakzio mota berezia da, lotura polar baten atomo elektronegatibo bati kobalenteki lotzen zaion H atomoaren eta atomo elektronegatibo (O.N edo F) baten artean gertatzen den erakarpen elektroestatiko bat alegia.[7]
Hidrogeno-lotura hauek, molekulen artean (intermolekularki) nahiz molekula baten zati desberdinen artean (intramolekularki) gerta daitezke.
Lotura hau dipolo-dipolo indar elektroestatiko oso sendoa da, molekula asko lotuta daudenean, asko egonkortzen baita, baina lotura kobalente edo ionikoak baino ahulagoak dira.

Deskribatzeko modua:
A-HB edo A-HA
A eta B= atomo elektronegatiboak (O,N, edo F)
A-H= Molekula bat, edo baten zatia
B=molekula baten zatia
Lotura honen adibiderik garbiena ur molekulen artean sortzen diren hidrogeno loturak dira. Alegia, ur molekula baten H atomoaren eta beste ur molekula baten oxigeno atomo elektronegatiboaren artean sortzen dira.
Hidrogen-loturaren sendotasuna, loturan parte hartzen duten bi atomoen erakartze elektrostatikoaren menpekoa da
Gainera, substantzia baten ezaugarri fisiko-kimikoak alda ditzake. Alegia, fusio- edo irakite-puntuak espero baino altuagoak izatea eragiten du.

Indukzio-indarrak[aldatu | aldatu iturburu kodea]
Molekula apolarra den arren, molekula hau dipolo induzitu bihur liteke. Dipolo induzitu hauek, aurrerago azaldutako orientazio-indarrek bezalako erakarpen elektroestatikoak sortzen dituzte. Baina, nola sortzen dira dipolo induzitu hauek? Hainbat aukera daude: batetik, katioi bat gerturatzea eta, bestetik, molekula polar bat gerturatzea. Honela sortzen diren interakzioak, ioi-dipolo induzituen artekoak eta dipolo-dipolo induzituen artekoak dira .[8]
Dispertsio-indarrak[aldatu | aldatu iturburu kodea]

Sakabanatze-indarrak ere esaten zaie . Edozein atomo, espezie edo molekulen artean gertatzen dira, nahiz eta apolarrak izan, hauek ere molekularen inguruan hodei elektroniko bat baitute. Kontuan izanik molekulak ez daudela geldirik, alegia, bibratzen daudela, bribrazio honek eragingo du elektroi-hodeiaren banaketa ez izatea guztiz homogeneoa momentuoro. Honek aldi uneko dipoloak sortzea eragiten du .
Beraz, sorturiko une bateko dipolo honek ondoan duen molekulari eragin diezaioke eta dipolo induzitu berri bat sortuko da. Pixkanaka-pixkanaka efektua zabalduz joango da.
Erreferentziak[aldatu | aldatu iturburu kodea]
- ↑ Química. (Ed. en español. argitaraldia) Reverté D.L. 1990 ISBN 8429171835. PMC 625153836. (Noiz kontsultatua: 2018-12-13).
- ↑ (Gaztelaniaz) de Anda Cárdenas, Pascual. Quimica 1. Ediciones Umbral, 124 or. ISBN ISBN 9789709758290...
- ↑ Gerischer, Heinz. (1995-01-05). «The World of Physical Chemistry. VonK. J. Laidler. Oxford University Press, Oxford, 1993. 488 S., geb. 55.00 £. – ISBN 0-19-855597-0» Angewandte Chemie 107 (1): 133–133. doi:. ISSN 0044-8249. (Noiz kontsultatua: 2018-12-13).
- ↑ James, Hubert M.; Coolidge, Albert Sprague. (1933-12). «The Ground State of the Hydrogen Molecule» The Journal of Chemical Physics 1 (12): 825–835. doi:. ISSN 0021-9606. (Noiz kontsultatua: 2018-12-13).
- ↑ R., Rayner,. (1995). Pump users handbook. (4th ed. argitaraldia) Elsevier Advanced Technology ISBN 9781856172165. PMC 162130579. (Noiz kontsultatua: 2018-11-26).
- ↑ Gandolfo, Otávio Coaracy Brasil; Gallas, José Domingos Faraco. (2007-09). «O arranjo pólo-dipolo como alternativa ao dipolo-dipolo em levantamentos 2D de eletrorresistividade» Revista Brasileira de Geofísica 25 (3): 227–235. doi:. ISSN 0102-261X. (Noiz kontsultatua: 2018-11-26).
- ↑ Vallejos, Margarita; Peruchena, Nélida M.. (2008-09-01). «Análisis AIM y NBO del enlace de hidrógeno aromático C-H...π en el complejo C2H2/C6H6» FACENA 22: 43. doi:. ISSN 1851-507X. (Noiz kontsultatua: 2018-11-26).
- ↑ Zeegers-Huyskens, Th.; Huyskens, P.. (1991). «Intermolecular Forces» Intermolecular Forces (Springer Berlin Heidelberg): 1–30. ISBN 9783642762628. (Noiz kontsultatua: 2018-11-26).






