Lankide:Maiderayerra/Proba orria
Ezaugarriak
[aldatu | aldatu iturburu kodea]Forma eta egitura
[aldatu | aldatu iturburu kodea]

Metalak distiratsuak dira prestatu, leundu edo hautsi berriak direnean, behintzat. Mikrometro lodi gutxi batzuk baino gehiagoko metalezko xaflek opako dirudite, baina urrezko ogiak argi berdea transmititzen du.
Metalen egoera solidoak edo likidoak, neurri handi batean, osatzen dituzten atomo metalikoek beren elektroiak kanpoko geruzatik erraz galtzeko duten gaitasunaren ondorio da. Oro har, atomo baten kanpoko geruzako elektroiak atxikitzen dituzten indarrak ahulagoak izaten dira metal solidoaren edo likidoaren atomoen arteko interakzioetatik sortzen diren elektroi berekiko erakarpen-indarrak baino. Inplikatutako elektroiak deslokalizatu egiten dira, eta metalen elektroi-egitura elektroi-laino mugikor samarretan txertatutako atomo-bilduma gisa ikus daiteke. Interakzio mota horri lotura metaliko esaten zaio[1]. Oinarrizko metalen lotura metalikoen indarra maximora iristen da trantsizioko metalen seriearen erdigunearen inguruan, elementu horiek elektroi deslokalizatu kopuru handiadeslokalizatutako elektroi kopuru handia handia baitute.
Oinarrizko metal gehienek ez-metal gehienek baino dentsitate handiagoak dituzten arren, dentsitateen artean aldakortasun handia dago. Litioa da dentsitate txikiena duena (0,534 g/cm3) eta, osmioa, aldiz, dentsitate handiena duena (22,59 g/cm3). Magnesioa, aluminioa eta titanioa garrantzi komertzial handiko metal arinak dira. Euren 1,7, 2,7 eta 4,5 g/cm3-ko dentsitateak egiturazko metal zaharrenenekin aldera daitezke, hala nola burdinarenakin (7,9 g/cm3) eta kobrearenakin (8,9 g/cm3). Beraz, burdinazko bola batek bolumen bereko hiru aluminio-bolaren pisua edukiko luke.
Metalak malguak eta harikorrak izan ohi dira, eta bereizi gabe deformatzen dira tentsiopean.[2] Lotura metalikoen izaera ez-norabidezkoak nabarmen laguntzen du solido metaliko gehienen moldakortasunerako. Aitzitik, konposatu ionikoetan, hala nola mahaiko gatzean, lotura ioniko baten planoak elkarren ondoan lerratzen direnean, kokapen-aldaketak gertatzen dira, eta karga bereko ioiak hurbildu egiten direlarik, kristala apurtu egiten da. Desplazamendu hori ez da ikusten lotura kobalentea duten kristaletan, diamantean adibidez, kristala hautsi eta zatitu egiten baita[3]. Metalen deformazio elastiko itzulgarria leheneratze-indarrentzako Hookeren legearen bidez deskriba daiteke, deskriba daiteke: tentsioa deformazioarekiko linealki proportzionala da.
Beroak edo metal baten muga elastikoak baino indar handiagoek deformazio iraunkorra (atzeraezina) eragin dezakete,deformazio plastiko edo plastikotasun esaten zaiona. Aplikatutako indarra trakziokoak, konpresiokoak, zizailatzekoak, tolestekoak edo bihurdurakoak izan daitezke. Tenperatura-aldaketek batek metalaren egitura-akatsen mugimenduan edo desplazamenduan eragin dezakete, besteak beste, ale-mugetan, huts puntualetan, lerro- eta torloju-dislokazioetan, pilaketa-failetan eta makletan, hala metal kristalinoetan nola ez-kristalinoetan. Metalaren barne-lerradurak, jarioa eta metal-nekea gerta daitezke.
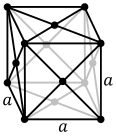
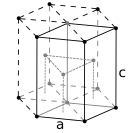
Substantzia metalikoen atomoak hiru egitura kristalino ohikoenetako
bat eduki ohi dute, hau da, gorputzean zentratutako egitura kubikoa (gzk), aurpegian zentratutako egitura kubikoa (azk) edo egitura hexagonal itxia (hi). Gzk-an, atomo bakoitza beste zortzi atomoz inguratutako kubo baten erdian dago. Azk eta hi motetan, atomo bakoitza beste hamabi atomoz inguratuta dago, baina geruzen pilaketa desberdina da. Metal batzuek egitura desberdinak hartzen dituzte tenperaturaren arabera.[4]
-
Gorputzean zentratutako egitura kubikoa, adibidez kromoa, burdina edo wolframioa.
-
Aurpegian zentratutako egitura kubikoa, adibidez aluminioa, kobrea edo urrea.
-
Paketatze trinkoa hexagonoetan, 6 atomoko gelaxka unitatea, adibidez, titanioa, kobaltoa eta zinka
Kristal-egitura bakoitzaren gexkala unitatea kristalaren simetria globala duen atomo multzorik txikiena da, eta horretatik abiatuta kristal-sare osoa eraiki daiteke hiru dimentsiotan errepikatuz. Aurrez erakutsitako gorputzean zentratutako kristal-egitura kubikoaren kasuan, gelaxka unitatea erdiko atomoak eta izkinetako zortzi atomoetako bat-zortzik osatzen dute.
Elektrikoak eta termikoak
[aldatu | aldatu iturburu kodea]Metalen egitura elektronikoak aztertuta, elektrizitate-eroale nahiko onak direla ondoriozta daiteke. Materiako elektroiek energia-maila finkoak izan ditzakete aldagaien ordez, eta metal batean elektroien energia-mailak, maila jakin bateraino gutxienez, eroapen elektrikoak izan ditzakeen energia-mailei dagozkie. Silizioa edo sufre ez-metalikoa bezalako erdieroaleetan, energia-eten bat dago substantziaren elektroien eta eroapen elektrikoa gerta daitekeen energia-mailaren artean. Ondorioz, erdieroaleak eta ez-metalak nahiko eroale eskasak dira.
Oinarrizko metalek 6,9 × 103 S/cm-ko elektrizitate-eroaletasunaren balioak dituzte manganesorako, eta 6,3 × 105 S/cm-koa zilarrerako. Aitzitik, boroa bezalako metaloide erdieroaleek batek eroankortasun elektrikoa du, 1,5 × 10–6 S/cm. Nolanahi ere, elementu metalikoek eroankortasun elektrikoa murrizten dute berotzen direnean. Plutonioak elektrizitate-eroapena handitzen du, -175 eta +125 °C bitarteko tenperatura-tartean berotzen denean.
Metalak nahiko bero-eroale onak dira. Metalen elektroi-hodeiko elektroiak oso mugikorrak dira, eta erraz transmiti dezakete beroak eragindako bibrazio-energia.
Metalen elektroiek haren ahalmen termikoari eta bero-eroaletasunari egiten dioten ekarpena eta metalaren eroankortasun elektrikoa elektroi askeen ereduaren bidez kalkula daitezke. Hala ere, horrek ez du kontuan hartzen metalaren ioi-egitura zehatza egitura zehatza. Nukleo ionikoen kokapenak eragindako potentzial positiboa kontuan hartuta, metalen banda elektronikoaren egitura eta energia loteslea deskriba daitezke. Zenbait eredu matematiko aplika daitezke, sinpleena elektroi-eredua ia askea izanik.
Ezaugarri Kimikoak
[aldatu | aldatu iturburu kodea]Elektroiak galdu eta katioiak sortzeko joera izaten dute metalek. [5] Gehienek aireko oxigenoarekin erreakzionatu eta oxidoak epe desberdinetan (potasio-erredurak segundotan, burdina urteetan zehar oxidatzen den bitartean). Beste batzuek, hala nola paladioak, platinoak eta urreak, ez dute batere erreakzionatzen atmosferareko oxigenoarekin. Metal-oxidoak, oro har, basikoak dira, ez-metalak ez bezala, azidoak edo neutroak izaten direnak. Salbuespenak, oxidazio-egoera oso handiko oxidoak dira, hala nola CrO3, Mn2O7 eta OsO4, , guztiz azidoak baitira.
Pintura, anodizazioa edo estaldura metalen korrosioa saihesteko modu onak dira. Hala ere, serie elektrokimikoan metal erreaktiboagoa aukeratu behar da estaldurarako, batez ere estaldura irristatzea espero denean
- ↑ Mortimer, Charles E.. (1983). Chemistry. (5th ed. argitaraldia) Wadsworth Pub. Co ISBN 0-534-01184-5. PMC 8552913. (Noiz kontsultatua: 2022-06-08).
- ↑ «Hogg, John C., Alley, Otis E., and Rickel, Charles L. Chemistry. New York: D. Van Nostrand Company, 1953. 772 p» Science Education 37 (5): 341–341. 1953-12 doi:. ISSN 0036-8326. (Noiz kontsultatua: 2022-10-25).
- ↑ «Ductility Review - Strength Mechanics of Materials» www.engineersedge.com (Noiz kontsultatua: 2022-06-08).
- ↑ Wiberg, Egon. (2001). Inorganic chemistry. (1st English ed.. argitaraldia) Academic Press ISBN 0-12-352651-5. PMC 48056955. (Noiz kontsultatua: 2022-10-25).
- ↑ «Hogg, John C., Alley, Otis E., and Rickel, Charles L. Chemistry. New York: D. Van Nostrand Company, 1953. 772 p» Science Education 37 (5): 341–341. 1953-12 doi:. ISSN 0036-8326. (Noiz kontsultatua: 2022-10-21).