Indar intermolekular
Indar intermolekular edo molekulen arteko indarra molekulen artean, beren izaeraren arabera, dauden elkarreraginei dagokie. Orokorrean, elkarreraginean ari diren molekulen polaritatearen arabera egiten da sailkapena edo, molekulen izaeraren arabera, berau osatzen duten elementuen arabera.
Lotura kimikoa atomoak elkarrekin eusten dituen indarra da, molekulak edo ioiak sortzeko. Bi lotura kimiko mota daude: lotura kobalenteak (atomoek elektroiak partekatzen dituztenak) eta elkarrekintza ez-kobalente ahulak (ioi, molekulen eta molekulen zatien arteko elkarrekintza ahulak).
Elkarreragin ez-kobalente ahulei, «ahul» deritze espezie molekularrak elkarrekin eusten dituen energia adierazten dutelako eta lotura kobalenteak baino dezente ahulagoak direlako. Oinarrizko elkarrekintza ez-kobalenteak hauek dira:
- Hidrogeno-lotura-indarra
- Van der Waals-en indarrak, eta hauek, aldi berean, sailka ditzakegu:
- ioi - dipolo .
- dipolo - dipolo.
- dipolo - induzitutako dipolo.
- London-en dispertsio-indarrak berehalako dipolo edo eragindako dipolo bezala ezagutzen dira.
Historia[aldatu | aldatu iturburu kodea]
1967an, Jean-Marie Lehnn kimikari frantziarrak, lehen aldiz, kimika supramolekularra garatu zuen, zeina, elkarrekintza ez-kobalenteen bidez, atxikitako lotura molekularren azterketan eta erabileran zentratua dagoen, hidrogeno loturak eta Van der Waals indarrak bezala. Eremu hori lotura kobalenteen kimika klasikoaren luzapen gisa ikus daiteke, atomoak lotzen dituena molekulak sortzeko, lotura ez-kobalentearen kimikarekin, molekulak batzen dituena, eta, sarritan, J.M. Lehn-i jarraituz etiketatu ohi da, besterik gabe, «kimika molekula baino haratago» gisa[1].
Lotura kobalenteekin alderatuta, molekulen arteko elkar eraginak ahulak dira, eta, tradizioz, kimikarien arreta erakartzen dute espezie kopuru handian parte hartzen duten prozesuei dagokienez; adibidez, solbatazioa, gainazaleko fenomenoak, presio handiko gasen portaera fisikoa, etab. Hala ere, sistema biologiko batzuk aztertuz, ikusten dugu oinarrizko hainbat prozesu —hala nola erreplikazioa, antigorputz-antigeno elkarrekintzak, entzimaren katalisia— eraginkortasun harrigarriarekin egiten direla bi molekularen artean indar intermolekularraren ekintza oso ondo antolatua dela eta. Kimika supramolekularraren garapena sistema biologikoen azterketarekin oso lotuta dago, eta hori ere islatzen da arlo horretan erabiltzen den terminologian. Molekula biologikoen egiturak mantentzeko eta horien funtzionamendurako, elkarrekintza ez-kobalenteek duten garrantziaren aurkikuntzak elkarrekintza horien izaerari buruzko azterketak bultzatu zituen, eta, beste aldetik, prozesu biologiko batzuk erreproduzitzen saiatu ziren; adibidez, sistema kimikoetan, zelula-mintzetan zehar ioien garraioak edo katalisi entzimatikoek erreaktibo analitikoen, katalizatzaileen, sendagaien eta abarren diseinu-printzipio berriak garatzera eraman zituzten.
Hidrogeno lotura[aldatu | aldatu iturburu kodea]
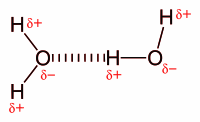
Hidrogeno-lotura gertatzen da hidrogeno-atomo bat nitrogeno, oxigeno edo fluor bezalako atomo elektronegatibo oso batekin lotzen denean[2]. Hidrogeno atomoak karga positibo partzial bat darama eta beste atomo elektronegatibo batzuekin elkar eragin dezake beste molekula batean (berriz, N, O edo F). Era berean, nolabaiteko gainjartze bat dago H eta lotzen den atomoaren artean (N, O edo F), espezie horien tamaina txikia dela eta. Bestalde, zenbat eta elektronegatibotasun-aldea handiagoa izan H eta eragiten duen atomoaren artean, orduan eta sendoagoa da lotura. Suposizio horien ondorioz, hidrogeno-loturaren intentsitate-ordena gero eta handiagoa lortzen dugu: F-rekin osatutakoa O-rekin osatutakoa baino biziagoa izango da, eta hori N-rekin osatutakoa baino biziagoa izango da. Fenomeno horiek elkarren arteko ekintza egonkortzailea eragiten dute, bi molekulak elkarrekin mantentzen dituena. Hidrogeno-loturaren adibide garbia ura da:
Hidrogeno-loturak natura osoan aurkitzen dira. Urari, bere propietate partikularrak ematen dizkiote, Lurrean bizia garatzea ahalbidetzen dutenak. Hidrogeno-loturek, DNA molekula batean, bi kateak elkarrekin eusten dituen molekularteko indarra ere ematen dute.
Lotura polarra osatzen ari den hidrogeno atomoaren arteko interakzio dipolo-dipolo berezi bat da, hala nola N—H, O—H edo F—H, eta O, N edo F bezalako atomo elektronegatibo baten artean. elkarren arteko ekintza hori honela adierazten da:
A—H•••BA—H•••A
A eta Bk O, edo F adierazten dute; A—H molekula bat edo molekula baten zati bat da, eta B beste baten zati da. Puntu-lerroek hidrogeno-lotura adierazten dute.
Hidrogeno-lotura baten batez besteko energia nahiko handia da dipolo-dipolo elkarren arteko ekintzarako (40 KJ / mol baino handiagoa). Horri esker, hidrogeno-lotura garrantzi handikoa da egitura jakin batzuk hartzeko orduan eta konposatu askoren propietateetan.
Interakzio mota horren existentziaren lehen froga irakite puntuen azterketatik etorri zen. Normalean, talde bereko elementuak dituzten konposatuen irakite-puntuak hazi egiten dira pisu molekularrekin. Baina, irudian ikus daitekeenez, 15, 16 eta 17 taldeetako elementuen konposatuek ez dute arau hori betetzen. Talde bakoitzeko, pisu molekular baxueneko konposatuek (NH3, H2O, HF) dute irakite-puntu altuena, espero zitekeenaren kontra. Hori gertatzen da egoera likidoan dauden molekulen artean lurrun egoerarako trantsizioari aurka egiten dion elkarren arteko ekintza mota bat dagoelako; ekintza hori hidrogeno-lotura da, eta, elektronegatiboenak direnez, serieko lehen kideei eragiten die; beraz, XH lotura da polarizatuena, eta horrek eragiten du hidrogeno-loturaren interakziorik handiena. Hidrogeno-loturak bereziki sendoak dira ur molekulen artean, eta substantzia horren propietate berezi askoren kausa dira. Taula periodikoko oxigenoaren ondoko elementuen hidrogeno-konposatuak eta bere familiako kideak giro-tenperaturan dauden gasak dira: CH4, NH3, H2S, H2Te, PH3, HCl. Aitzitik, H2O likidoa da giro-tenperaturan, eta molekulen arteko erakarpen maila handia adierazten du. Irudian, uraren irakite-puntua 100 °C-koa dela ikus daiteke, hidrogeno loturarik ez balego aurreikusiko litzatekeena baino handiagoa. Hidrogeno-loturek ere funtsezko zeregina dute DNAren egituran, izaki bizidun guztien ondare genetikoa gordetzen duen molekulan.
Van der Waals-en indarra[aldatu | aldatu iturburu kodea]
Dispertsio-indarrak, London-indarrak edo dipolo-iragankortasun-indarrak izenez ere ezagunak, lotura kobalente apolarrak dituzten molekulen arteko elkarrekintzei dagozkie aldi baterako polarizazio-fenomenoen ondorioz. Indar horiek honela azaltzen dira: molekulek karga elektriko garbirik ez dutenez, une jakin batzuetan, eskualde batean beste batean baino elektroi-dentsitate handiagoa dagoen banaketa sor dezakete; beraz, mementoko dipolo bat agertzen da.
Behar bezala orientatutako eta polarizatutako molekula horietako bi elkarrengana nahikoa hurbiltzen direnean, indar elektriko erakargarriak nahikoa indartsuak izan daitezke molekularteko loturak sortzeko. Indar horiek oso ahulak dira, eta molekulen tamainarekin handitzen dira.
(dipolo iraunkorra) HOH----Cl-Cl (dipolo iragankorra)
Bigarren kasuaren adibide bat kloro molekulan aurkitzen da:
(+) (-) (+) (-)
(dipolo iragankorra) Cl-Cl----Cl-Cl (dipolo iragankorra)
Dipolo-dipolo erakarpenak[aldatu | aldatu iturburu kodea]
Dipolo-dipolo erakarpena molekula bereko bi molekula polar edo bi talde polarren arteko elkarrekintza ez-kobalentea da, hura molekula handia bada. Dipoloak diren molekulek elkar erakartzen dute baten eskualde positiboa bestearen eskualde negatibotik hurbil daudenean.
Haien jatorria elektrostatikoa da, eta Coulomben Legearen arabera uler daiteke. Zenbat eta memento dipolar handiagoa izan, orduan eta indar handiagoa izango dute.
Dipolo-dipolo erakarpenak dipolo iraunkorrak dituzten bi molekulen artean gertatzen diren indarrak dira; horiek Keeson bezala ere ezagunak dira Willem Hendrik Keesom-engatik, lehen deskribapen matematikoa egin baitzuen 1921ean. Horiek elkarrekintza ionikoen antzera funtzionatzen dute, baina ahulagoak dira karga partzialak baino ez dituztelako. Horren adibide bat azido klorhidrikoan ikus daiteke:
![]() aldi berean dipolo negatibo eta positiboa duen molekularen artean gehi kargarik gabeko atomo normal baten artean ere gerta daitezke.
aldi berean dipolo negatibo eta positiboa duen molekularen artean gehi kargarik gabeko atomo normal baten artean ere gerta daitezke.
Interakzio ionikoak[aldatu | aldatu iturburu kodea]
Kargatutako molekula ezberdinen artean, Katioi-anioi mailan gertatzen diren elkarrekintzak dira, eta, beraz, elkartasun elektrostatiko bat osatzeko joera izango dute kontrako kargen muturren artean, haien arteko erakarpenaren ondorioz.
Horren adibide garbia da karboxilo eta aminoaren aminoazido, peptido, polipeptido edo proteina bat beste baten muturren artean gertatzen dena.
Londonen edo dispertsio indarrak[aldatu | aldatu iturburu kodea]
Londonen indarrak substantzia molekular guztietan gertatzen dira. Aldameneko molekulek eragindako dipoloen mutur positibo eta negatiboen arteko erakarpenaren ondorio dira.
Gas nobleen atomoek ere berehalako dipoloak dituzte: hau da, oxigenoa, nitrogenoa eta kloroa bezalako gas diatomiko molekulek (apolarrak izan behar dute) eta hidrokarburo molekulek CH4, C2H6 bezalako molekulek.
Londonen indarren intentsitatea molekula baten elektroien polarizatze-erraztasunaren araberakoa da, eta hori molekulako elektroi kopuruaren eta erakarpen nuklearrak zenbateraino eusten dituen araberakoa. Oro har, zenbat eta elektroi gehiago egon molekula batean, orduan eta errazago polarizatu daiteke. Beraz, elektroi asko dituzten molekula handiagoak nahiko polarizagarriak dira. Aitzitik, molekula txikiagoak polarizagaitzagoak dira, elektroi gutxiago dituztelako. Maxwell-en indarrak, gutxi gorabehera, 0,05 eta 40 kJ/mol artean aldatzen dira.
Molekula ez-polarren hainbat talderen irakite-puntuak aztertzen ditugunean, laster nabaritzen da elektroi kopuruaren eragina. Efektu hori masa molarrarekin ere erlazionatzen da: atomo edo molekula bat zenbat eta astunagoa izan, orduan eta elektroi gehiago ditu. Maxwell-en indarren sorreran forma molekularrak ere zeresana duela Interesgarria da.
Pentanoaren bi isomerok —kate zuzeneko pentanoa eta 2,2-dimetilpropanoa (biak C5H12 formula molekularra dutenak)—, irakite-puntuetan, 27 °C-tan desberdintzen dira. N-pentano molekulak, bere linealtasuna dela eta, kontaktu estua ahalbidetzen du ondoko molekulekin, 2,2-dimetilpropano molekula esferikoagoak, berriz, ukipen hori onartzen ez duen bitartean.
Ioi-dipolo indarrak[aldatu | aldatu iturburu kodea]
Espezie kargatuen artean gertatzen diren elkarrekintzak dira. Antzeko kargek elkar uxatzen dute kontrako kargek elkar erakartzen duten bitartean.
Memento dipolo-iraunkorra duen ioi baten eta molekula polar neutro baten artean dagoen indarra da. Molekula polarrak dipoloak dira (mutur positiboa eta mutur negatiboa dute). Ioi positiboak dipolo baten mutur negatibora erakarriak izaten dira, ioi negatiboak mutur positibotik erakarriak diren bitartean, elkarren artean lotzen dira.
Katioien kargak (karga elektriko positiboa) kontzentratuago daude ioi horiek anioiak baino txikiagoak izan ohi direlako (karga elektriko negatiboa). Ondorioz, magnitude bereko karga batekin, katioi batek anioi batek baino interakzio indartsuagoa izaten du dipoloekin.
Elkar eraginaren energia da: ioiaren kargaren (Q), dipoloaren memento dipolarraren (µ) eta ioiaren erdigunetik dipoloaren erdigunera (d) den distantziaren araberakoa.
Ioi-dipolo indarrak garrantzitsuak dira substantzia ionikoen disoluzioetan.
Ioi-dipolo elkarrekintzaren adibide bat hidratazioa da. Hidratazioaren beroa konposatu ioniko baten katioien eta anioien arteko elkarreragin onaren emaitza da.
Molekularteko indarren eragina propietate fisiko eta kimikoetan[aldatu | aldatu iturburu kodea]
Molekularteko indarrak milioika molekulen artean daudenez, eredu horrek konposatu ezberdinen propietate fisikoak eta kimikoak kualitatiboki zein desberdinak diren azaltzeko balio du.
Ekarpenak[aldatu | aldatu iturburu kodea]
Zientziak pertsonen bizitza zabaltzeko eta errazteko bideak bilatu ditu; bide horien artean aurkitu da proteinen egituraketan interakzio molekularrak baliagarriak direla mediku-teknologiak garatzeko, besteak beste, terapiarako zelula amak sortzeko eta gaixotasunak aztertzeko; ekzema prebenitzeko proteinen manipulazioa; proteina ia perfektuen sorrera iraupenerako sekretu gisa, eta forma artifizial berriak giza genomaren bidez.
Zelula amak lortzea[aldatu | aldatu iturburu kodea]
San Diegoko Scripps Research Institute-k zelula- amak lortu daitezkeela aurkitu du, eta horiek lortzeko enbrioiak suntsitzeko beharra albora dezake; horrela, pazientearen espezifikoak diren zelula amak sortzeko metodo bat izango dute, besteak beste, tumoreak, anemiak, gaixotasunen terapia eta sortzetiko nahasmendu metabolikoak eta immunitate-sistemaren gabeziaren ikerketetan erabiltzeko.
Aurkikuntza hori proteinak zeluletan txertatzean datza, molekularteko elkarrekintzak eraginez jatorrizko egoerara itzultzen diren eta gorputzeko zelula ezberdin gisa erabil daitezkeen zelulak eratuz. «Gainera, sagu-zeluletan probatu den prozesuak ez dakar enbrioi edo obuluen suntsipenik, eta hori izan zen hain eztabaidagarri bihurtu zuen zelula-amen enbrioi ikerketa» (Pera, 2012)[3].
Proteinen manipulazioa ekzema saihesteko[aldatu | aldatu iturburu kodea]
Ondorioztatu da IL-21 proteinak ekzemaren garapenean larruazaleko azkura eta minaren aurkako tratamendu prebentziozkoak ekar ditzakeela. Raif Geha doktoreak, Bostongo Haur Ospitaleko eta Harvardeko Medikuntza Eskolako alergia eta immunologia pediatriako dibisioko buruak, baieztatzen du proteina horiek manipulatzeko aukera IL-21 gaixotasunaren sorreran garrantzitsua dela ekzema prebenitzeko, eta, aurrerantzean, etorkizuneko tratamenduei bidea ireki liezaiokeela frogatu du. Hala ere, muga bat da saguekin esperimentatzerakoan horietako batzuek ez zutela albo-ondoriorik sortu, eta, beraz, ez da ezagutzen gizakiengan eragin kaltegarriak izan ditzakeen. «Eragozpenak sortu diren arren, esperimentuek jarraitzen dute, proteina horren egitura manipulatuz, ekzemari aurre egin diezaiokeen formula aurki daitekeela» (Rockman, 2011)[4].
Proteinak[aldatu | aldatu iturburu kodea]
Bizitza-luzeraren sekretua proteina ia perfektuen erabileran dagoela aurkitu da. Proceedings of the National Academy of Sciences aldizkarian argitaratutako artikulu batean, Vera Gorbunova eta Andrei Seluanov ikertzaileek proteina ia perfektuen aurkikuntza deskribatzen dute sator-arratoi erribosometan zentratuz; ikusi dute rRNA kateak bi toki zehatzetan zatitu eta erdiko segmentuan baztertzen direla —bere kabuz flotatu beharrean. Harizpi bakoitzeko gainerako bi piezak elkarrengandik hurbil geratzen dira, eta erribosoma proteinak biltzen diren aldamio gisa jokatzen dute erribosoma bat sortzeko. Erribosomak, aminoazidoak lotzen dituenean proteina bat sortzeko, noizean behin, errore bat gertatzen da aminoazido okerra sartzen denean. Gorbunova eta Seluanov-ek aurkitu zuten sator-arratoien zelulek ekoitzitako proteinek beste eredu batzuetako zelulek ekoitzitako proteinek baino 40 aldiz akats gutxiago izateko probabilitate gehiago dutela: «hori garrantzitsua da aberraziorik gabeko proteinek organismoa eraginkorrago funtzionatzen laguntzen dutelako. Hala ere, oraindik bide luzea dago egiteko, rRNA beste eredu esperimental batzuetan banatzean proteinen sintesia modulatu ahal izateko» (Seluanov, 2012)[5].
Forma artifizial berriak[aldatu | aldatu iturburu kodea]
Forma artifizial berriak sortzea bizitza birdiseinatzeko idealarekin sortzen den proposamen teknologiko berri bat da, hau da, sabelean dagoen bitartean pertsonen genomak hutsetik aldatzeko eta bakterio edo bakterio baten makineria zelularra behartzeko legamia aminoazido artifizialak sintetizatzeko eta haien proteinei gehitzeko aukera izatea.
Gainera, denbora laburrean forma bizidun berriak sortzeko aukerari eusten dio, hori biologia sintetikoarekin dator, zeina ez baita konforme espezie batetik bestera geneak bakartzea, sekuentziatzea, aldatzea eta transplantatzearekin, baizik eta nahi duena da zirkuitu eta mekanismo biologikoen bidez funtzionatzen duten sistema biologiko artifizial propioak eskala handian eraikitzea.
Drew Endy biologoak, Massachusettseko Teknologia Institutuko Biologia Sintetikoko Taldeko buruak, dio: molekulen arteko indarrak erabiliz, aurreikusteko moduko portaera duten eta artifizialki zabaldutako kode genetiko batekin funtzionatzen duten sistema bizidunak diseinatu eta eraikitzeko sortu daitezkeela. Izan ere, Juan Valcárcel Heidelbergeko Biologia Molekularreko Europako Laborategiko (EMBL) ikertzailea ados dago, eta uste du posible izango dela enbrioi baten informazio genetikoan edo pertsona baten zeluletan esku hartzea gaixotasun hereditarioak sortzen dituzten akats genetikoak zuzentzeko, hala nola fibrosi kistikoa edo bizkarrezurreko atrofia muskularra, baina zailagoa izango dela organismoaren bizitzan zehar sortzen diren akats genetikoak zuzentzea, hala nola minbizia, normalean ez baitira gene bakar batean gertatzen[6].
Biologikoak[aldatu | aldatu iturburu kodea]
Lotura kobalentearen eta elkarrekintza ez-kobalente ahulen arteko aldea da lotura kobalenteak egitura primarioen arduradunak direla, biopolimero bakoitzaren konposizioa eta identitatea eta talde molekular bakoitzak hartzen dituen «konfigurazioak» definitzen dituela, elkarrekintza ez-kobalente ahulak diren bitartean. Makromolekula biologikoen eta egituraz gaindiko konplexuen arkitektura molekularra ezaugarritzen duten konformazioen konplexutasunaz arduratzen da, hau da, intramolekularrak (atomoak edo makromolekularen barruan dauden talde molekularrak) eta molekularteko elkarrekintzak; beraz ezinbestekoak dira funtzio biologikoetarako[7], baina molekula handiagoa izan daiteke.
Erreferentziak[aldatu | aldatu iturburu kodea]
- ↑ La Enciclopedia de las Ciencias y Tecnología en México. (13 de octubre de 2009). Química Supramolecular. .
- ↑ Enlace de Hidrógeno.
- ↑ Ding, S.. (2012). Las Proteínas: Obtención de Células Madre. .
- ↑ Geha, R.. (2011). Las proteínas: Manipulación de Proteínas para impedir eczemas. .
- ↑ El Médico Interactivo. (2012). La creación de proteínas casi perfectas puede ser el secreto de la longevidad. .
- ↑ Coperías, E. M.. (2005). Llegan los seres sintéticos. .
- ↑ Universidad de Granada. Fuerzas inter e intramoleculares que determinan las estructuras de las Macromoléculas Biológicas. .