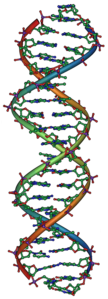
Molekula



Kimikan, molekula deitzen zaio bi atomo edo gehiagoz osatuta dagoen egiturari. Atomo horiek lotura kimiko sendoen bidezko antolamendu definitua dute, elektrikoki neutroa eta aski egonkorra dena.[4][5][6][7][8][9] Kimika organikoan eta biokimikan, molekula terminoak ez dauka esanahi hain hertsia, eta, askotan, molekula organiko kargatuei eta biomolekulei ere aplikatzen zaie. Zentzu hertsian, molekulak eta ioi poliatomikoak bereiztu egiten dira.
Molekularen egitura hobeto ezagutu ahala, definizio hau aldatzen joan da. Aurreko definizioak zehazgabeagoak ziren: substantzia kimikoen konposizio eta propietate kimikoak atxikitzen zituen partikularik txikienatzat hartzen zen molekula.[10] Definizio hau sarritan ez zen betetzen, eguneroko substantzia asko (esaterako, hainbat arroka, gatz edo metal), ez baitaude molekulaz eginak.
Gasen teoria zinetikoan, molekula terminoa edozein gas-partikuletarako erabiltzen da, bere osaera kontuan hartu gabe.[11] Definizio honek badauka desabantaila bat: gas nobleak ere molekulak izango lirateke, loturarik gabeko atomo bakunez osatuta baitaude.
Molekulen antzeko kontzeptuak antzinatik eztabaidatzen dira, baina molekulen izaerari eta haien loturei buruzko ikerketa modernoa XVII. mendean hasi zen. Denborarekin, Robert Boyle, Amedeo Avogadro, Jean Perrin eta Linus Pauling moduko zientzialariek finduta, molekulen ikerketa, gaur egun, fisika molekularra edo kimika molekularra izenez ezagutzen da.
Etimologia[aldatu | aldatu iturburu kodea]
Merriam-Webster eta Online Etimologia Hiztegiaren arabera molekula hitza latinezko moles edo masa unitate txikitik dator. Hitza molécule frantses hitzetik dator (1678), molecula neo-latinotik, latinezko moleten txikitzailea, masa, hesia. Hitza, XVIII. mendearen amaiera arte latinez bakarrik erabiltzen zena, ezaguna egin zen Descartesen filosofia lanetan erabili ondoren[12][13].
Historia[aldatu | aldatu iturburu kodea]
Molekularen definizioak eboluzionatu egin du molekulen egituraren ezagutza handitu ahala. Lehengo definizioak ez ziren hain zehatzak, eta molekulak oraindik konposizioa eta propietate kimikoak mantentzen dituzten substantzia kimiko puruen partikula txikien gisa definitzen zituzten[14]. Definizio hori askotan hautsi egiten da esperientzia arruntean substantzia asko (arrokak, gatzak eta metalak...) kimikoki loturiko atomo edo ioien sare kristalino handiz osatuta daudelako, baina ez daude molekula diskretuez osatuta.
Molekulen kontzeptu modernoa Leuzipo eta Demokrito gisako filosofo aurrezientifiko greziarrengandik atzera egiten du, zeinek unibertso guztia atomoz eta hutsunez osatuta dagoela argudiatu baitzuten. K.a. 450 inguruan, Enpedoklesek oinarrizko elementuak irudikatu zituen (sua
(![]() ), Lurra (
), Lurra (![]() ), airea (
), airea (![]() ), eta ura (
), eta ura (![]() ), eta erakarpen- eta aldaratze indarrak elementuek elkarrekintzan jarduteko aukera ematen dute.
), eta erakarpen- eta aldaratze indarrak elementuek elkarrekintzan jarduteko aukera ematen dute.
Bosgarren elementu bat, eterraren kintesentzia ustelgaitza, zeru-gorputzen funtsezko eraikigarritzat hartzen zen. Leuzipo eta Enpedoklesen begiratokia, eterrarekin batera, Aristotelesek onartu zuen, eta Erdi Aroko eta Berpizkundeko Europara igaro zen.
Baina modu zehatzagoan, atomo agregatuen edo unitateen kontzeptuak (hau da, molekulak) jatorria Robert Boyleren 1661eko hipotesian du, The Sceptical Chymist izeneko bere tratatu ospetsuan: materia partikula-multzoz osatua dagoela eta aldaketa kimikoa kumuluen berrantolaketaren ondorio dela. Boylek materiaren oinarrizko elementuak hainbat partikula mota eta tamainatan zeudela argudiatu zuen, korpuskuluak deiturikoak, eta horiek taldetan antolatzeko gai zirela. 1789an, William Higginsek azken partikulen konbinazioei buruzko iritziak argitaratu zituen, balentzia loturen teoria aurreikusten zutenak. Higginsen arabera, oxigenoaren azken partikularen eta nitrogenoaren azken partikularen arteko indarra 6 balitz, orduan, indarraren indarra horren arabera zatituko litzateke, eta berdin azken partikulen gainerako konbinazioentzat.
Amedeo Avogadrok sortu zuen molekula hitza[15]. 1811ko bere Essay on Determining the Relative Masses of the Elementary Molecules of Bodies artikuluan, funtsean, hau dio Partingtonen A Short History of Chemistry liburuaren arabera[16]:
| « | Gasen partikula txikienak ez dira zertan atomo soilak izan, erakarpen bidez elkartuta molekula bakar bat eratzeko atomo horietako kopuru jakin batez osatuta baizik. | » |
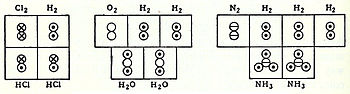
Kontzeptu horiekin koordinatuta, 1833an, Marc Antoine Auguste Gaudin kimikari frantziarrak Avogadroren hipotesiaren azalpen argia aurkeztu zuen[17] pisu atomikoei buruz bolumen diagramak erabiliz, zeinak argi erakusten dituzten bi geometria molekular erdi-zuzenak, hala nola ur molekula lineal gisa zein formula molekular zuzenak, hala nola H2O:
1917an, Linus Pauling izeneko gradu-ingeniari kimiko estatubatuar ezezagun bat Dalton-en kako eta begi-lotura metodoa ikasten ari zen, garai hartan atomoen arteko loturen deskribapen nagusia zena. Pauling, ordea, ez zegoen metodo horrekin konforme, eta sortu berria zen fisika kuantikoaren eremura begiratu zuen metodo berri baten bila. 1926an, Jean Perrin fisikari frantziarrak Fisikako Nobel Saria jaso zuen molekulen existentzia modu erabakigarrian frogatzeagatik. Avogadroren konstantea kalkulatuz egin zuen hiru metodo ezberdin erabiliz, guztiak fase likidoko sistemak inplikatuz. Lehenik eta behin, ganbogeko xaboi-itxurako emultsioa erabili zuen; bigarrena, Brownar higidurari buruzko lan esperimentala eginez, eta, hirugarrena, Einsteinen partikulen errotazioaren teoria fase likidoan baieztatuz[18].
1927an, Fritz London eta Walter Heitler fisikariek mekanika kuantiko berria aplikatu zuten hidrogeno molekularen erakarpen eta aldaratze indar saturagarri eta ez dinamikoei aurre egiteko. Arazo horren balentzia-loturaren tratamendua, beren artikulu bateratuan, mugarria izan zen[19], kimika kuantikoaren menpe ekarri baitzuen. Haien lanak eragina izan zuen Paulingengan, doktoretza egin berria baitzuen eta Heitler eta London bisitatu zituen Zurichen, Guggenheim beka batekin.
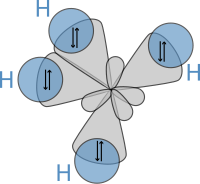
Geroago, 1931n, Heitler eta Londonen lanetan eta Lewisen artikulu ospetsuan aurkitutako teorietan oinarrituta, Paulingek bere artikulu aitzindaria argitaratu zuen The Nature of the Chemical Bond[20], non mekanika kuantikoa erabili zuen propietateak eta molekulen egiturak kalkulatzeko, hala nola loturen arteko angeluak eta loturen inguruko biraketa. Kontzeptu horiei buruz, Paulingek hibridazio-teoria garatu zuen CH4 bezalako molekulen loturak kontuan hartzeko, zeinetan hibridatutako lau sp³ hidrogenoaren 1s orbitalarekin gainjartzen diren lau sigma (σ) lotura emanez. Lau loturak luzera eta indar berekoak dira, eta horrek behean erakusten den egitura molekularra ematen du:
Zientzia molekularra[aldatu | aldatu iturburu kodea]
Molekulen zientziari kimika molekularra edo fisika molekularra deitzen zaio, fokua kimika edo fisika denaren arabera. Kimika molekularrak lotura kimikoen eraketa eta haustura eragiten duten molekulen arteko elkarrekintza arautzen duten legeez dihardu; fisika molekularra, berriz, haien egitura eta propietateak arautzen dituzten legeez. Praktikan, ordea, bereizketa hori lausoa da. Zientzia molekularretan, molekula bat bi atomoz edo gehiagoz osatutako sistema egonkor batek (egoera lotua) osatzen du. Batzuetan, ioi poliatomikoak elektrikoki kargatutako molekulatzat har daitezke. Molekula ezegonkor terminoa espezie oso erreaktiboetarako erabiltzen da, hau da, elektroien eta nukleoen iraupen laburreko multzoetarako (erresonantziak), hala nola erradikalak, ioi molekularrak, Rydberg molekulak, trantsizio-egoerak, van der Waals konplexuak edo talka egiten duten atomoen sistemak Bose-Einstein kondentsatuan moduan.
Prebalentzia[aldatu | aldatu iturburu kodea]
Molekulak ohikoak dira materiaren osagai gisa. Ozeano eta atmosfera gehienak ere osatzen dituzte. Substantzia organiko gehienak molekulak dira. Bizitzaren substantziak molekulak dira, adibidez, proteinak, horiek osatzen dituzten aminoazidoak, azido nukleikoak (DNA eta RNA), azukreak, karbohidratoak, gantzak eta bitaminak. Mantenugai mineralak, orokorrean, konposatu ionikoak dira, beraz, ez dira molekulak, adibidez, burdin sulfatoa.
Hala ere, Lurreko substantzia solido ezagun gehienak kristalez edo konposatu ionikoz osatuta daude partzialki edo guztiz, eta horiek ez daude molekulez osatuta. Horien artean daude Lurraren substantzia osatzen duten mineral guztiak: harea, buztina, haitzak, harriak, hondoa, urtutako barrualdea eta Lurraren muina. Horiek guztiek lotura kimiko asko dituzte, baina ez daude identifika daitezkeen molekulaz eginak.
Ezin da molekula tipikorik definitu gatzetarako, ez eta kristal kobalenteetarako ere, nahiz eta horiek plano batean hedatzen diren zelula unitate errepikakorrek osatuta egon ohi diren, adibidez, grafenoa; edo hiru dimentsioan, adibidez, diamantea, kuartzoa, sodio kloruroa. Unitate-zelula egitura errepikatuaren gaia lotura metalikoko fase kondentsatuak diren metal gehienentzat ere balio du. Beraz, metal solidoak ez dira molekulaz eginak. Beiretan (kristalezko egoera desordenatuan dauden solidoak), atomoak lotura kimikoen bidez mantentzen dira, definitu daitekeen molekularik gabe edo kristal kobalenteak eta metalak bereizten dituen egitura zelularra errepikatzen duen erregulartasunik gabe ere.
Lotura kimikoak[aldatu | aldatu iturburu kodea]
Molekulak osatzen dituzten atomoak elkarrekin mantentzen dira lotura kobalenteen edo lotura ionikoen bidez. Zenbait elementu ez-metaliko molekula gisa bakarrik existitzen dira ingurunean. Adibidez, hidrogenoa hidrogeno-molekula gisa bakarrik existitzen da. Konposatu baten molekula bi elementuk edo gehiagok osatzen dute. Molekula homonuklear bat elementu bakarreko bi atomok edo gehiagok osatzen dute.
Pertsona batzuek diote metalezko kristal bat lotura metalikoen bidez lotutako molekula erraldoi bakartzat har daitekeela, baina beste batzuek diote metalek molekulek ez bezala jokatzen dutela.[21]
Lotura kobalentea[aldatu | aldatu iturburu kodea]
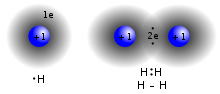
Lewis-en ereduaren arabera, lotura kobalentea bi atomoen artean elektro-bikote bat edo gehiago konpartitzeagatik sortzen den elkarketa edo lotura da.[22]
Elektroiak batera konpartitzea honetan datza: atomo bakoitzak loturarako erabilitako elektroia edo elektroiak, beste atomoaren kanpo-geruzaren parte izatera ere pasatzen dira.
Lotura ionikoa[aldatu | aldatu iturburu kodea]
Lotura ionikoa ioi positiboen eta negatiboen arteko indar elektrostatikoen presentziaren kausaz sare kristalino ionikoa eratuz sortzen den bildura edo elkarketa-modua da.[23]
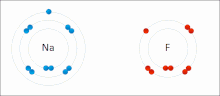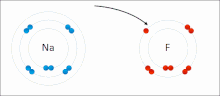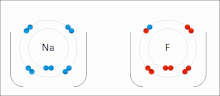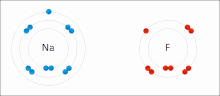
Ioiak elektroi bat edo gehiago galdu dituzten atomoak dira (katioi izenekoak) eta elektroi bat edo gehiago irabazi dituzten atomoak (anioi izenekoak) . Elektroien transferentzia horri elektrobalentzia esaten zaio kobalentziarekin kontrastean. Kasurik sinpleenean, katioia metalezko atomo bat da eta anioia atomo ez-metaliko bat, baina ioi hauek izaera konplexuagokoak izan daitezke, adibidez, NH4+ edo SO4 2- bezalako ioi molekularrak.
Tenperatura eta presio normaletan, lotura ionikoak batez ere solidoak (edo batzuetan likidoak) sortzen ditu molekula identifikagarri bereizirik gabe, baina material horien lurruntzeak/sublimazioak molekula bereizi txikiak sortzen ditu, non elektroiak oraindik kobalenteen ordez ioikotzat jotzeko adina transferitzen diren.
Molekulen tamaina[aldatu | aldatu iturburu kodea]
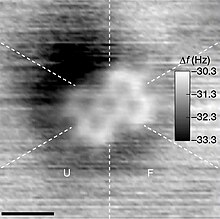
Molekula gehienak txikiegiak dira begi hutsez ikusteko, nahiz eta polimero askotako molekulak tamaina makroskopikoetara iritsi daitezkeen, ADN moduko biopolimeroak barne. Sintesi organikorako eraikuntza-bloke gisa erabili ohi diren molekulek angstrom (Å) gutxitik dozena Å bitarteko dimentsioa dute, edo metro baten bilioiren bat ingurukoa. Molekula bakarrak ezin dira normalean argiaren bidez behatu (goian adierazi moduan), baina molekula txikiak eta atomo indibidualen eskemak miatu daitezke, zenbait zirkunstantziatan, indar atomikoko mikroskopioa erabiliz. Molekula handienetako batzuk makromolekulak edo supermolekulak dira.
Molekula txikiena hidrogeno diatomikoa (H2) da, 0,74 Å-ko lotura-luzera duena[24].
Erradio molekular eraginkorra molekula batek disoluzioan erakusten duen tamaina da[25][26]. Substantzia ezberdinen permselektibitatearen taulak adibideak ditu.
Definizioa eta mugak[aldatu | aldatu iturburu kodea]
Orokortasunez begiratuta, substantziaren ezaugarri kimikoak mantentzen dituen substantziaren osagairik txikiena har daiteke molekula gisa, zeinaren bidez (eta erreakzio kimikorik egin gabe) substantzia berreraiki daitekeen. Definizio horrekin bat etorriz, gas nobleen molekula monoatomikoak deskribatu daitezke oso erabilgarria den molekulez osatutako substantzia puruetan, baina zailtasun nabarmenak erakusten ditu sare kristalinoak, gatzak, metalak eta beira gehienak deskribatzerakoan.
Molekula labilek euren trinkotasuna azkar batean galdu dezakete, baina, euren batez besteko bizialdia bibrazio molekular batzuena bezainbestekoa bada, molekula gisa har ezin daitekeen trantsizio-egoera baten aurrean egongo ginateke. Laser pultsatuei esker, gaur egun, sistema kimiko horien ikerketa egingarria da.
Molekulen definizioarekin bat datozen baina karga elektrikoa duten entitateei, ioi poliatomiko, ioi molekular edo ioi molekula deritze. Ioi poliatomikoz osatuta dauden gatzak, normalean, material molekular edo oinarri molekularra duten material gisa sailkatzen dira.
Molekulak partikulez osatuta daude. Molekula bat, arestian esan bezala, jatorrizko materialaren ezaugarriak mantentzen dituen materiaren osagairik txikiena da. Molekulak elkarren artean lotura kimikoak eratu dituzten atomoz osatuta daude.
Molekula substantzia monoatomiko edo poliatomiko baten unitatea izan daiteke. Adibidez, substantzia gaseoso guztien unitatea molekula da[27].
Molekula motak[aldatu | aldatu iturburu kodea]
Molekulak honela sailka daitezke:
- Molekula diskretuak: atomo kopuru zehatz batez osatuak, atomo horiek elementu berekoak izan (molekula homonuklearrak, dinitrogenoa edo fulerenoa kasu) edo elementu desberdinetakoak (molekula heteronuklearrak, ura adibidez).
- Makromolekulak edo polimeroak: unitate sinple baten errepikapenaz osatuak — edo unitate horien multzo mugatu batez — eta pisu molekular erlatiboki altuak lortzen dituztenak.
-
Ur molekula, disolbatzaile unibertsala, hainbat prozesu biokimiko eta industrialetan ezinbestekoa.
-
Keggin anioiaren irudikapen poliedrikoa, polianioi molekularra.
-
Polietilenoaren irudikapena, gehien erabiltzen den plastikoa.
Deskribapena[aldatu | aldatu iturburu kodea]
Egitura molekularra hainbat modutan deskriba daiteke. Molekularen formula kimikoa erabilgarria da molekula sinpleetarako, hala nola H2O urarentzat edo NH3 amoniakoarentzat. Hauek molekulan dauden elementuen sinboloak dituzte, baita azpiindizeek adierazitako proportzioa ere.
Molekula konplexuagoetarako, adibidez kimika organikoan aurkitzen direnetarako, formula kimikoa ez da nahikoa, eta haratago joan beharra dago, formula estruktural bat erabiliz, talde funtzional desberdinen antolaketa espaziala grafikoki adierazteko.
Proteinak, DNA edo polimeroak bezalako sistema oso konplexuak direnean, irudikapen bereziak erabiltzen dira, hala nola hiru dimentsioko ereduak (fisikoak edo ordenagailuz irudikatuak). Proteinetan, adibidez, honako hauek bereiz daitezke: egitura primarioa (aminoazidoen ordena), sekundarioa (helizeetan, hostoetan, birak), tertziarioa (globuluak emateko helize/orri/biraketa motako egiturak tolestea) eta kuaternarioa (globulu desberdinen arteko espazio-antolamendua).
Formula molekularrak[aldatu | aldatu iturburu kodea]
Molekula baten formula kimikoak elementu kimikoen sinboloen lerro bat erabiltzen du, zenbakiak eta, batzuetan, beste sinbolo batzuk ere bai, hala nola parentesiak, marratxoak, parentesiak eta gehi (+) eta minus (-) zeinuak. Horiek sinbolo-lerro tipografiko batera mugatzen dira, azpiindizeak eta gainindizeak izan ditzaketenak.
Konposatu baten formula enpirikoa formula kimiko oso sinplea da[28]. Bera osatzen duten elementu kimikoen erlazio zenbaki oso sinpleena da[29]. Adibidez, ura beti dago hidrogeno eta oxigeno atomoen arteko 2:1 proportzioz osatuta, eta etanola (alkohol etilikoa) karbonoz, hidrogenoz eta oxigenoz osatuta dago beti 2:6:1 proportzioan. Hala ere, horrek ez du molekula mota zehatzik zehazten; dimetil eterrak etanolaren proportzio berak ditu, adibidez. Antolamendu desberdinetan, atomo berdinak dituzten molekulei, isomero deitzen zaie. Karbohidratoek ere, adibidez, proportzio bera dute (karbonoa:hidrogenoa:oxigenoa= 1:2:1) (eta, beraz, formula enpiriko bera) baina, molekulako, atomo kopuru desberdinak.
Formula molekularrak molekula osatzen duten atomo kopuru zehatza islatzen du, eta, beraz, molekula desberdinak bereizten ditu. Hala ere, isomero ezberdinek konposizio atomiko bera izan dezakete molekula desberdinak izanik.
Formula enpirikoa formula molekularraren berdina izan ohi da, baina ez beti. Adibidez, azetileno molekulak C2H2 formula molekularra du, baina elementuen arteko erlazio sinpleena CH da.
Masa molekularra formula kimikotik kalkula daiteke, eta karbono-12 (12C isotopo) atomo neutro baten masaren 1/12ko masa atomiko konbentzionaletan adierazten da. Sare-solidoetarako, formula-unitate terminoa erabiltzen da kalkulu estekiometrikoetan.
Formula estrukturala[aldatu | aldatu iturburu kodea]
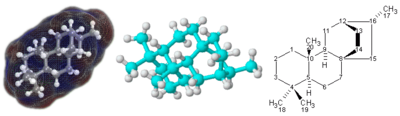
3 dimentsioko egitura konplikatua duten molekulen kasuan, batez ere lau ordezkatzaile ezberdinekin loturiko atomoak inplikatuta, baliteke formula molekular soil bat edo formula kimiko erdi-egiturala nahikoa ez izatea molekula guztiz zehazteko. Kasu horretan, formula estruktural izeneko formula grafiko bat behar izan daiteke. Egiturazko formulak dimentsio bakarreko izen kimiko batekin irudika daitezke, baina nomenklatura kimiko horrek formula kimikoen parte ez diren hitz eta termino asko behar ditu.
Geometria molekularra[aldatu | aldatu iturburu kodea]
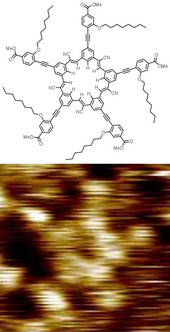
Molekulek oreka-geometria finkoak dituzte —lotura-luzerak eta angeluak—, eta, horien inguruan, etengabe oszilatzen dute bibrazio- eta errotazio-higiduraren bidez. Substantzia purua batez besteko egitura geometriko bera duten molekulek osatzen dute. Formula kimikoa eta molekula baten egitura dira bere propietateak zehazten dituzten bi faktore garrantzitsuak, bereziki bere erreaktibitatea. Isomeroek formula kimiko bat partekatzen dute, baina, normalean, oso propietate desberdinak dituzte egitura ezberdinengatik. Estereoisomeroek, isomero mota jakin batek, propietate fisiko-kimiko oso antzekoak izan ditzakete, eta, aldi berean, jarduera biokimiko desberdinak izan ditzakete.
Espektroskopio molekularra[aldatu | aldatu iturburu kodea]
Espektroskopia molekularra energia ezaguneko (edo maiztasuneko, Planck erlazioaren arabera) zundaketa-seinaleekin elkarreragiten duten molekulen erantzuna (espektroa) jorratzen du. Molekulek, absorbantzia edo igorpenaren bidez, molekulen energia-trukea detektatuz azter daitezkeen energia-maila kuantizatuak dituzte[32]. Espektroskopiak ez die, orokorrean, neutroiak, elektroiak edo energia handiko X izpiak moduko partikulek molekulen antolaketa erregular batekin elkarreragiten duten difrakzio-azterketei erreferentzia egiten (kristal batean moduan).
Mikrouhinen espektroskopia, normalean, molekulen errotazioaren aldaketak neurtzen ditu, eta kanpoko espazioko molekulak identifikatzeko erabil daiteke. Espektroskopia infragorriak molekulen bibrazioa neurtzen du, luzatze, tolestura edo bihurridura mugimenduak barne. Molekulen lotura edo talde funtzionalak identifikatzeko erabili ohi da. Elektroien antolamendu-aldaketek xurgapen- edo igorpen-lerroak ematen dituzte argi ultramorean, ikusgaian edo infragorri hurbilean, eta kolorea sortzen dute. Erresonantzia nuklearraren espektroskopia molekulako nukleo jakinen ingurunea neurtzen du, eta molekula bateko posizio ezberdinetan dauden atomo kopuruak ezaugarritzeko erabil daiteke.
Alderdi teorikoak[aldatu | aldatu iturburu kodea]
Fisika molekularraren eta kimika teorikoaren bidez, molekulen azterketa mekanika kuantikoan oinarritzen da neurri handi batean, eta ezinbestekoa da lotura kimikoa ulertzeko. Molekulen artean, sinpleena hidrogeno molekula-ioia da, H2+, eta, lotura kimiko guztien artean, elektroi bateko lotura da sinpleena. H2+ positiboki kargatutako bi protoiz eta negatiboki kargatutako elektroi batez osatuta dago, eta horrek esan nahi du sistemarako Schrödinger-en ekuazioa errazago ebatzi daitekeela elektroi-elektroiaren aldaratze faltagatik. Ordenagailu digital azkarren garapenarekin, molekula konplikatuagoetarako gutxi gorabeherako soluzioak posible egin ziren, eta kimika konputazionalaren alderdi nagusietako bat dira.
Atomoen antolamendu bat molekulatzat hartzeko nahikoa egonkorra den ala ez zehazten saiatzen denean, IUPAC-ek iradokitzen du: «energia potentzialaren gainazaleko depresio bati dagokiona, gutxienez bibrazio-egoera bat mugatzeko nahikoa sakona den»[33]. Definizio hori ez dago atomoen arteko elkarrekintzaren izaeraren araberakoa, elkarrekintzaren indarraren araberakoa baizik. Izan ere, tradizionalki molekulatzat hartuko ez liratekeen espezie ahulak biltzen ditu, hala nola helio-dimeroa, He2, bibrazio-egoera bat duena[34] eta hain eskas lotzen dena, non litekeena da oso tenperatura baxuetan soilik behatzea.
Atomoen antolaketa molekulatzat hartzeko nahikoa egonkorra den ala ez definizio operatiboa da berez. Filosofikoki, beraz, molekula bat ez da oinarrizko entitate bat (esaterako, oinarrizko partikula baten aldean); aitzitik, molekula kontzeptua kimikariak behatzen ditugun munduan eskala atomikoko elkarrekintzen indarguneei buruzko adierazpen baliagarri bat egiteko modua da.
Erreferentziak[aldatu | aldatu iturburu kodea]
- ↑ (Ingelesez) Iwata, Kota; Yamazaki, Shiro; Mutombo, Pingo; Hapala, Prokop; Ondráček, Martin; Jelínek, Pavel; Sugimoto, Yoshiaki. (2015-07-16). «Chemical structure imaging of a single molecule by atomic force microscopy at room temperature» Nature Communications 6 (1): 7766. doi:. ISSN 2041-1723. PMID 26178193. PMC PMC4518281. (Noiz kontsultatua: 2023-06-13).
- ↑ (Ingelesez) Dinca, L. E.; Marchi, F. De; MacLeod, J. M.; Lipton-Duffin, J.; Gatti, R.; Ma, D.; Perepichka, D. F.; Rosei, F.. (2015-02-05). «Pentacene on Ni(111): room-temperature molecular packing and temperature-activated conversion to graphene» Nanoscale 7 (7): 3263–3269. doi:. ISSN 2040-3372. (Noiz kontsultatua: 2023-06-13).
- ↑ (Ingelesez) Hapala, Prokop; Švec, Martin; Stetsovych, Oleksandr; van der Heijden, Nadine J.; Ondráček, Martin; van der Lit, Joost; Mutombo, Pingo; Swart, Ingmar et al.. (2016-05-27). «Mapping the electrostatic force field of single molecules from high-resolution scanning probe images» Nature Communications 7 (1): 11560. doi:. ISSN 2041-1723. PMID 27230940. PMC PMC4894979. (Noiz kontsultatua: 2023-06-13).
- ↑ IUPAC
- ↑ Pauling, Linus. (1970). General Chemistry. New York: Dover Publications, Inc. ISBN 0-486-65622-5..
- ↑ Ebbin, Darrell, D.. (1990). General Chemistry. (3. argitaraldia) Boston: Houghton Mifflin Co. ISBN 0-395-43302-9..
- ↑ Brown, T.L.. (2003). Chemistry – the Central Science. (9. argitaraldia) New Jersey: Prentice Hall ISBN 0-13-066997-0..
- ↑ Chang, Raymond. (1998). Chemistry. (6. argitaraldia) New York: McGraw Hill ISBN 0-07-115221-0..
- ↑ Zumdahl, Steven S.. (1997). Chemistry. (4. argitaraldia) Boston: Houghton Mifflin ISBN 0-669-41794-7..
- ↑ Molekularen definizioa (Frostburg State University)
- ↑ Ikus [1]
- ↑ Harper, Douglas. "molecule". Online Etymology Dictionary. Retrieved 22 February 2016.
- ↑ "molecule". Merriam-Webster. Archived from the original on 24 February 2021. Retrieved 22 February 2016.
- ↑ «Molecule». Encyclopædia Britannica. 2016-01-22. 2016-02-23an begiratua.
- ↑ Galaxy v24n05 (1966 06). (Noiz kontsultatua: 2023-06-14).
- ↑ «Amedeo Avogadro» web.lemoyne.edu (Noiz kontsultatua: 2023-06-14).
- ↑ (Ingelesez) Mauskopf, Seymour H.. (1969-04). «The Atomic Structural Theories of Ampère and Gaudin: Molecular Speculation and Avogadro's Hypothesis» Isis 60 (1): 61–74. doi:. ISSN 0021-1753. (Noiz kontsultatua: 2023-06-14).
- ↑ (Ingelesez) «The Nobel Prize in Physics 1926» NobelPrize.org (Noiz kontsultatua: 2023-06-14).
- ↑ (Alemanez) Heitler, W.; London, F.. (1927-06-01). «Wechselwirkung neutraler Atome und homöopolare Bindung nach der Quantenmechanik» Zeitschrift für Physik 44 (6): 455–472. doi:. ISSN 0044-3328. (Noiz kontsultatua: 2023-06-14).
- ↑ (Ingelesez) Pauling, Linus.. (1931-04). «THE NATURE OF THE CHEMICAL BOND. APPLICATION OF RESULTS OBTAINED FROM THE QUANTUM MECHANICS AND FROM A THEORY OF PARAMAGNETIC SUSCEPTIBILITY TO THE STRUCTURE OF MOLECULES» Journal of the American Chemical Society 53 (4): 1367–1400. doi:. ISSN 0002-7863. (Noiz kontsultatua: 2023-06-14).
- ↑ Portillo, Germán. (2021-10-12). «Zer dira metalak: ezaugarriak, sailkapena eta motak» Renovables Verdes (Noiz kontsultatua: 2023-03-05).
- ↑ «Lewis Egitura Definizioa eta Adibidea» eu.eferrit.com (Noiz kontsultatua: 2023-03-05).
- ↑ Cosmos, Viaje al. (2020-07-16). «Esteka ionikoa: zer da?, Ezaugarriak, Adibideak eta gehiago ▷➡️ Postposmo» Postposmo (Noiz kontsultatua: 2023-03-05).
- ↑ (Ingelesez) DeKock, Roger L.; Gray, Harry B.. (1989). Chemical Structure and Bonding. University Science Books ISBN 978-0-935702-61-3. (Noiz kontsultatua: 2023-06-14).
- ↑ Chang, Ramsay L.S.; Deen, William M.; Robertson, Channing R.; Brenner, Barry M.. (1975-10). «Permselectivity of the glomerular capillary wall: III. Restricted transport of polyanions» Kidney International 8 (4): 212–218. doi:. ISSN 0085-2538. (Noiz kontsultatua: 2023-06-14).
- ↑ Chang, R.L.; Ueki, I.F.; Troy, J.L.; Deen, W.M.; Robertson, C.R.; Brenner, B.M.. (1975-09). «Permselectivity of the glomerular capillary wall to macromolecules. II. Experimental studies in rats using neutral dextran» Biophysical Journal 15 (9): 887–906. doi:. ISSN 0006-3495. PMID 1182263. PMC PMC1334749. (Noiz kontsultatua: 2023-06-14).
- ↑ Ocampo, Dapueto, Piovano (2009). «1». En Universidad Nacional del Litoral, ed. Química General. Santa Fé, Argentina: Ediciones UNL. p. 9. ISBN 978-987-508-965-5
- ↑ (Ingelesez) Wink, Donald J.; Fetzer-Gislason, Sharon; McNicholas, Sheila. (2003-03). The Practice of Chemistry. Macmillan ISBN 978-0-7167-4871-7. (Noiz kontsultatua: 2023-06-14).
- ↑ «ChemTeam: Empirical Formula» www.chemteam.info (Noiz kontsultatua: 2023-06-14).
- ↑ (Ingelesez) Hirsch, Brandon E.; Lee, Semin; Qiao, Bo; Chen, Chun-Hsing; McDonald, Kevin P.; Tait, Steven L.; Flood, Amar H.. (2014-07-31). «Anion-induced dimerization of 5-fold symmetric cyanostars in 3D crystalline solids and 2D self-assembled crystals» Chemical Communications 50 (69): 9827–9830. doi:. ISSN 1364-548X. (Noiz kontsultatua: 2023-06-14).
- ↑ (Ingelesez) Zoldan, Vinícius Claudio; Faccio, Ricardo; Pasa, André Avelino. (2015-02-10). «n and p type character of single molecule diodes» Scientific Reports 5 (1): 8350. doi:. ISSN 2045-2322. PMID 25666850. PMC PMC4322354. (Noiz kontsultatua: 2023-06-14).
- ↑ Chemistry (IUPAC), The International Union of Pure and Applied. «IUPAC - spectroscopy (S05848)» goldbook.iupac.org doi:. (Noiz kontsultatua: 2023-06-14).
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Molecule". doi:10.1351/goldbook.M04002
- ↑ pubs.aip.org doi:. (Noiz kontsultatua: 2023-06-14).