Termodinamika
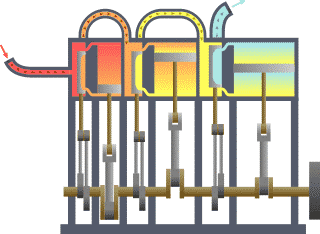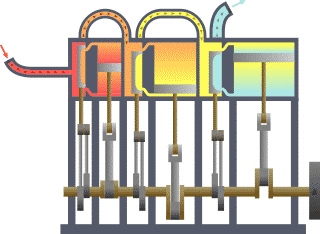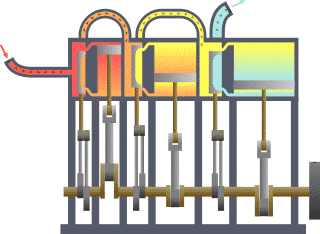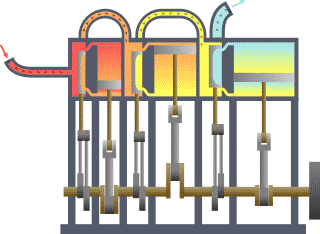
Termodinamika (grezieraz τερμον "beroa" eta δυναμις "dinamika") fisikaren adar bat da, beroa, lana eta tenperatura tratatzen dituena, eta hura energiarekin, entropiarekin eta materiaren eta erradiazioaren propietate fisikoekin erlazionatzen duena. Magnitude horien portaera termodinamikaren lau legeek arautzen dute. Lege horiek deskribapen kuantitatibo bat transmititzen dute magnitude fisiko makroskopiko neurgarrien bidez, baina osagai mikroskopikoen terminoetan azal daitezke, mekanika estatistikoaren bidez. Termodinamika zientzia eta ingeniaritzako gai ugaritan aplikatzen da, bereziki kimika fisikoan, biokimikan, ingeniaritza kimikoan eta ingeniaritza mekanikoan, baina baita meteorologian ere.
Historikoki, termodinamika lehen lurrun-makinen eraginkortasuna handitzeko nahitik garatu zen, batez ere Sadi Carnot (1824) fisikari frantsesaren lanari esker, zeinak uste baitzuen motorren eraginkortasuna zela Frantziari Napoleondar Gerrak irabazten lagun ziezaiokeen gakoa[1]. Lord Kelvin fisikari eskoziar-irlandarra izan zen termodinamikaren definizio zehatza eman zuen lehena 1854an[2], honela zioena: "Termodinamika beroak gorputzen elkarren ondoan dauden zatien artean jarduten duten indarrekin duen harremanaren gaia da, eta beroak agentzia elektrikoarekin duen harremana". Rudolf Clausius fisikari eta matematikari alemaniarrak Carnoten zikloa bezala ezagutzen den Carnoten printzipioa birplanteatu zuen eta horrela beroaren teoriari oinarri egiazkoagoa eta sendoagoa eman zion. Bere artikulu garrantzitsuenak, "Beroaren indar eragileari buruz"[3], 1850ean argitaratua, termodinamikaren bigarren legea enuntziatu zuen lehen aldiz. 1865ean entropia kontzeptua sartu zuen. 1870ean, beroari aplikatutako birialaren teorema enuntziatu zuen.
Termodinamikaren hasierako aplikazioa motor termiko mekanikoetan berehala hedatu zen konposatu kimikoen eta erreakzio kimikoen azterketara. Termodinamika kimikoak entropiak erreakzio kimikoen prozesuan duen zeregina aztertzen du, eta hedapenaren eta eremuaren ezagutzaren zatirik handiena eman du. Termodinamikaren beste formulazio batzuk sortu ziren. Termodinamika estatistikoa, edo mekanika estatistikoa, partikulen mugimendu kolektiboaren iragarpen estatistikoez arduratzen da, haien portaera mikroskopikotik abiatuta. 1909an, Constantin Carathéodoryk formulazio axiomatiko baten ikuspegi matematiko hutsa aurkeztu zuen, sarritan termodinamika geometrikoa esaten zaion deskribapena.
Sarrera[aldatu | aldatu iturburu kodea]
Edozein sistema termodinamikoren deskribapenak oinarri axiomatikoa osatzen duten termodinamikaren lau legeak erabiltzen ditu. Lehenengo legeak zehazten du energia sistema fisikoen artean transferitu daitekeela, hala nola beroa, lana eta materiaren transferentziarekin[4]. Bigarren legeak entropia izeneko kantitate baten existentzia definitzen du, termodinamikoki sistema batek bilakaera izan dezakeen norabidea eta sistema baten ordena-egoera kuantifikatzen duena; entropia sistematik atera daitekeen lan erabilgarria kuantifikatzeko erabil daitekeen[5].
Termodinamikan objektu-multzo handien arteko elkarreraginak aztertu eta sailkatzen dira. Horretarako, funtsezkoak dira sistema termodinamikoaren eta ingurunearen kontzeptuak. Sistema bat partikulek osatzen dute, eta partikulen batez besteko mugimenduek propietateak definitzen dituzte, eta partikulak, aldi berean, egoera-ekuazioen bidez erlazionatzen dira. Propietateak konbinatu egin daitezke barne-energia eta potentzial termodinamikoak adierazteko, horiek baliagarriak baitira oreka-baldintzak eta prozesu espontaneoak zehazteko.
Tresna horiekin, termodinamika erabil daiteke sistemek inguruneko aldaketei nola erantzuten dieten deskribatzeko. Hau zientziaren eta ingeniaritzaren gai ugariri aplika dakieke, hala nola motorrak, fase-trantsizioak, erreakzio kimikoak, garraio-fenomenoak eta are zulo beltzak ere. Termodinamikaren emaitzak funtsezkoak dira fisikaren eta kimikaren beste arlo batzuetarako, ingeniaritza kimikorako, korrosioaren ingeniaritzarako, ingeniaritza aeroespazialerako, ingeniaritza mekanikorako, biologia zelularrerako, ingeniaritza biomedikorako, materialen zientziarako eta ekonomiarako, batzuk aipatzearren[6][7].
Artikulu hau termodinamika klasikoan oinarritzen da batez ere, oreka termodinamikoan dauden sistemak aztertzen baititu. Orekarik ezaren termodinamika tratamendu klasikoaren hedapen gisa tratatzen da askotan, baina mekanika estatistikoak aurrerapen asko ekarri ditu eremu horretara.
Historia[aldatu | aldatu iturburu kodea]
Termodinamikaren historia, diziplina zientifiko bezala, Otto von Guerickerekin hasten da. 1650ean munduko lehen huts-ponpa eraiki eta diseinatu zuen eta hutsaren existentzia frogatu zuen Magdeburgeko bere esfera-erdiak erabiliz. Guerickek hutsa egin nahi zuen Aristotelesek "naturak hutsa gorrotatzen duela" dioen ustea ezeztatzeko. Guericke baino geroxeago, Robert Boyle fisikari eta kimikari anglo-irlandarrak Guerickeren diseinuen berri izan zuen eta, 1656an, Robert Hooke zientzialari ingelesarekin koordinatuta, aire-bonba bat eraiki zuen. Bonba hori erabiliz, Boylek eta Hookek presio, tenperatura eta bolumenaren arteko korrelazioa ikusi zuten. Denborarekin, Boyleren Legea formulatu zen, presioa eta bolumena alderantziz proportzionalak direla ezartzen duena. Ondoren, 1679an, kontzeptu horietan oinarrituta, Boyleko kide batek, Denis Papin izenekoak, lurrun-digestore bat eraiki zuen. Lurruna ondo doitutako estalki batekin itxitako ontzi bat zen, eta lurruna konfinatzen zuen presio handia sortu arte.
Ondorengo diseinuek lurrunarentzako ihes-balbula bat zuten, makinak eztanda egitea eragozten zuena. Balbula erritmikoki igotzen eta jaisten ari zela ikusirik, Papinek pistoizko eta zilindrozko motor baten ideia asmatu zuen. Hala ere, ez zuen bere diseinua burutu. Hala ere, 1697an, Papinen diseinuetan oinarrituta, Thomas Savery ingeniariak lehen motorra eraiki zuen, 1712an Thomas Newcomenek jarraituta. Lehen motor horiek hasiberriak eta eraginkorrak ez ziren arren, garaiko zientzialari nagusien arreta erakarri zuten.
Termodinamikaren garapenerako beharrezkoak diren bero-gaitasunaren eta bero sorraren oinarrizko kontzeptuak Joseph Black irakasleak garatu zituen Glasgowko Unibertsitatean, non James Wattek instrumentuen eraikitzaile gisa lan egiten zuen. Blackek eta Wattek esperimentuak egin zituzten elkarrekin, baina Watt izan zen kanpoko kondentsadorearen ideia sortu zuena, lurrun-makinen errendimendua asko handitzea eragin zuena. Aurreko lan guztiak aprobetxatuz, Sadi Carnot "termodinamikaren aita"k Reflections on the Motive Power of Fire (1824) argitaratu zuen, beroari, potentziari, energiari eta motorren errendimenduari buruzko diskurtsoa. Liburuak Carnoten motorraren, Carnoten zikloaren eta indar eragilearen arteko oinarrizko harreman energetikoak zirriborratzen zituen. Termodinamikaren hasiera markatu zuen zientzia moderno gisa[8].
Clausiusek lehen aldiz aipatu zituen bigarren legearen oinarrizko ideiak 1850ean argitaratutako "Beroaren indar eragileari buruz" lanean, eta "termodinamikaren sortzaileetako bat" deitu zioten. Entropia kontzeptua sortu zuen 1865ean[9]. Termodinamikako lehen testu-liburua 1859an idatzi zuen William Rankinek, jatorrian fisikaria eta ingeniaritza zibil eta mekanikoko irakaslea Glasgowko Unibertsitatean[10]. Termodinamikaren lehen eta bigarren legeak aldi berean sortu ziren 1850eko hamarkadan, batez ere William Rankine, Rudolf Clausius eta William Thomsonen (Lord Kelvin) lanetatik abiatuta. Termodinamika estatistikoaren oinarriak James Clerk Maxwell, Ludwig Boltzmann, Max Planck, Rudolf Clausius eta J. Willard Gibbs fisikariek ezarri zituzten.
1873-76 urteetan, Josiah Willard Gibbs fisikari matematiko estatubatuarrak hiru lan argitaratu zituen, eta ezagunena On the Equilibrium of Heterogeneous Substances (Substantzia heterogeneoen orekari buruz) izan zen[11]. Bertan, prozesu termodinamikoak, erreakzio kimikoak barne, grafikoki azter zitezkeela erakusten zuen, sistema termodinamikoaren energia, entropia, bolumena, tenperatura eta presioa aztertuz, prozesu bat espontaneoki gertatuko ote zen zehazteko[12]. Pierre Duhemek ere, XIX. mendean, termodinamika kimikoari buruz idatzi zuen. XX. mendearen hasieran, Gilbert N. Lewis, Merle Randall[13] eta E. A. Guggenheim kimikariek Gibbsen metodo matematikoak aplikatu zituzten prozesu kimikoen analisian.
Termodinamikaren adarrak[aldatu | aldatu iturburu kodea]
Sistema termodinamikoen azterketa lotutako hainbat adarretan garatu da, eta adar horietako bakoitzak funtsezko eredu desberdina erabiltzen du oinarri teoriko edo esperimental gisa, edo printzipioak sistema mota desberdinei aplikatzen dizkie.
Termodinamika klasikoa[aldatu | aldatu iturburu kodea]
Termodinamika klasikoa orekatik gertu dauden sistema termodinamikoen egoeren deskribapena da, propietate makroskopikoak eta neurgarriak erabiltzen dituena. Energia, lan eta bero trukeak modelizatzeko erabiltzen da, termodinamikaren legeetan oinarrituta. Klasiko hizak gaiaren lehen ulermen-maila adierazten du, XIX. mendean garatu zen bezala, eta sistema baten aldaketak deskribatzen ditu parametro enpiriko makroskopikoei dagokienez (eskala handikoak eta neurgarriak). Ondoren, mekanika estatistikoaren garapenak kontzeptu horien interpretazio mikroskopikoa eman zuen.
Mekanika estatistikoa[aldatu | aldatu iturburu kodea]
Mekanika estatistikoa, termodinamika estatistiko bezala ere ezaguna, teoria atomiko eta molekularren garapenarekin sortu zen XIX. mendearen amaieran eta XX. mendearen hasieran, eta termodinamika klasikoa partikula indibidualen edo egoera mekaniko-kuantikoen arteko interakzio mikroskopikoen interpretazio batekin osatu zuen. Eremu honek atomoen eta molekula indibidualen propietate mikroskopikoak giza eskalan ikus daitezkeen materialen solteko propietate makroskopikoekin lotzen ditu, horrela termodinamika klasikoa estatistikaren, mekanika klasikoaren eta teoria kuantikoaren emaitza natural gisa azalduz maila mikroskopikoan.
Termodinamika kimikoa[aldatu | aldatu iturburu kodea]
Termodinamika kimikoa energiak erreakzio kimikoekin edo egoera fisikoaren aldaketarekin duen erlazioaren azterketa da, termodinamikaren legeen mugen barruan. Termodinamika kimikoaren helburu nagusia eraldaketa jakin baten espontaneotasuna determinatzea da[14].
Orekaren termodinamika[aldatu | aldatu iturburu kodea]
Orekaren termodinamika materiaren eta energiaren transferentziak aztertzea da, inguruko indarren eraginez oreka termodinamikoko egoera batetik bestera pasa daitezkeen sistema edo gorputzetan. "Oreka termodinamikoa" terminoak oreka-egoera bat adierazten du, eta fluxu makroskopiko guztiak nuluak dira; sistema edo gorputz sinpleenen kasuan, propietate intentsiboak homogeneoak dira, eta presioak mugekiko perpendikularrak. Oreka egoera batean ez dago potentzial desorekaturik, edo indar bultzatzailerik, makroskopikoki sistemaren zati ezberdinen artean. Orekaren termodinamikaren helburu nagusietako bat hau da: sistema bat hasierako oreka-egoera batean egonik, ondo definituta, eta haren ingurunea eta paretak kontuan hartuta, kalkulatzea zein izango den sistemaren azken oreka-egoera, zehaztutako eragiketa termodinamiko batek hormak edo ingurunea aldatu ondoren.
Oreka ezaren termodinamika[aldatu | aldatu iturburu kodea]
Oreka ezaren termodinamika termodinamikaren adar bat da, oreka termodinamikoan ez dauden sistemez arduratzen dena. Naturan dauden sistema gehienak ez daude oreka termodinamikoan, ez daudelako egoera egonkorretan, eta etengabe eta etenka materia- eta energia-fluxuen mende daudelako, beste sistema batzuetara eta beste sistema batzuetatik. Desorekan dauden sistemen azterketa termodinamikoak orekaren termodinamikarenak baino kontzeptu orokorragoak eskatzen ditu. Gaur egun ere, sistema natural asko gaur egun ezagutzen diren metodo termodinamiko makroskopikoen irismenetik kanpo daude.
Termodinamikaren legeak[aldatu | aldatu iturburu kodea]
Termodinamika, batez ere, lau legeren multzo batean oinarritzen da. Lege horiek unibertsalki baliozkoak dira horietako bakoitzak dakartzan murrizketen barruan sartzen diren sistemei aplikatzen zaizkienean. Termodinamikaren deskribapen teoriko ezberdinetan, lege hauek itxuraz modu ezberdinetan adieraz daitezke, baina formulazio nabarmenenak honako hauek dira:
Zero legea[aldatu | aldatu iturburu kodea]
Termodinamikaren zero legeak honako hau dio: Bi sistemako kide bakoitza hirugarren batekin oreka termikoan badaude, elkarren arteko oreka termikoan ere badaude.
Baieztapen horrek esan nahi du oreka termikoa baliokidetasun-erlazioa dela aintzat hartutako sistema termodinamikoen multzoan. Sistemak orekan daudela esaten da, haien arteko ausazko truke txikiek (adibidez, browndar mugimenduak) energia aldaketa garbirik eragiten ez badute. Lege hau tenperaturaren neurketa orotan aurresuposatzen da. Horrela, bi gorputz tenperatura berean dauden jakin nahi bada, ez da beharrezkoa kontaktuan jartzea eta denboran zehar ikus daitezkeen propietateen aldaketak neurtzea. Legeak tenperaturaren definizio enpirikoa ematen du eta termometro praktikoak eraikitzea justifikatzen du.
Zerogarren legea, hasiera batean, ez zen termodinamikatik bereizitako lege gisa onartu, oreka termodinamikoan zuen oinarria beste legeetan inplizitua baitzegoen. Lehen, bigarren eta hirugarren legeak esplizituki adierazita zeuden, eta komunitate fisikoan onarpen komuna zuten zero legeak tenperatura definitzeko zuen garrantzia ulertu aurretik. Beste legeak berriro zenbakitzea praktikoa ez zenez, zero legea deitu zen.
Lehenengo legea[aldatu | aldatu iturburu kodea]
Termodinamikaren lehenengo legeak, energiaren kontserbazioa ere deitua, sistema baten energia aldaketa, sistemari emandako beroa eta berarengan egindako lanaren batura dela dio.
non:
- dE: sistemaren energiaren aldaketa infinitesimala.
- δQ: bero trukaketa. Bero fluxua sistemarantz sartzen denean balio positiboa izango du. Bero fluxua sistematik kanpora ateratzen denean balio negatiboa izango du.
- δW: lan trukaketa. Balio positiboa sistemari egindako lana da, sartzen den energia. Sistemak egindako lana balio negatiboa izango du.
Lege hau ezin da fisikaren beste legeetatik eratorri, oinarrizko printzipio bat da, guztiz enpirikoa. Lege honen lehenengo adierazpena 1850ean Rudolf Clausiusek eman zuen. Esan zuenez, badago propietate bat, E, energia deitua, zeinetan bere aldaketa prozesu adiabatiko baten trukatutako lanaren berdina den. Prozesu adiabatiko bat bero trukaketa gabe gertatzen dena da, hortaz ikus daiteke aurreko ekuazioarekin baliokidetasuna.
Sistema bezala unibertsoa hartzen bada, ez dago ingururik unibertsoarekin beroa edo lana trukatuko duenik. Beraz, dE = 0, edo berdina dena, unibertsoaren energia konstantea da, horregatik lege honi energiaren kontserbazioa ere deitzen zaio.
E energia, barne energiaz, energia potentzialaz, energia zinetikoaz eta energia elektromagnetikoaz osatua dago. Askotan, energia hauen aldaketa prozesu batean baztergarria da, barne energiaren aldaketaren aldean. Horregatik, energia ordez barne energia (U) maiz erabiltzen da, eta ekuazioa hurrengo eran aurkitzea oso ohikoa da:
Beroa eta lana prozesuaren menpekoak dira. Aldiz energia, hasierako eta amaierako egoeren menpekoa da soilik.
Bigarren legea[aldatu | aldatu iturburu kodea]
Termodinamikaren bigarren legearen bertsio tradizional batek dio: Beroa ez da berez isurtzen gorputz hotzago batetik beroago batera.
Bigarren legeak materia- eta erradiazio-sistema bati egiten dio erreferentzia, hasieran tenperaturaren, presioaren, potentzial kimikoaren eta beste propietate intentsibo batzuen homogeneotasunik ezarekin, barneko "murrizketen" edo horma zurrun iragazgaitzen ondorioz, barruan, edo kanpotik ezarritako indarren ondorioz. Legeak ikusten duenez, sistema kanpoko mundutik eta indar horietatik isolatuta dagoenean, kopuru termodinamiko definitu bat dago, bere entropia, murrizketak ezabatu ahala handitzen dena, azkenik oreka termodinamikoan balio gorena lortuz, homogeneotasun ezak ia desagertzen direnean. Hasieran oreka termodinamikotik urrun dauden sistemetarako, nahiz eta batzuk proposatu diren, ez da ezagutzen oreka termodinamikora hurbiltzeko erritmoak zehazten dituen printzipio fisiko orokorrik, eta termodinamikak ez ditu erritmo horiek kontuan hartzen. Bigarren legearen bertsio ugariek oreka termodinamikora hurbiltzearen atzeraezintasuna adierazten dute.
Termodinamika makroskopikoan, bigarren legea edozein prozesu termodinamiko erreali aplika dakiokeen oinarrizko behaketa da; termodinamika estatistikoan, bigarren legea kaos molekularraren ondorio bat dela postulatzen da.
Hirugarren legea[aldatu | aldatu iturburu kodea]
Termodinamikaren hirugarren legeak honako hau ezartzen du: Sistema baten tenperatura zero absolutura hurbiltzen den heinean, prozesu guztiak eten egiten dira eta sistemaren entropia balio minimo batera hurbiltzen da.
Termodinamikaren lege hau entropiari eta tenperaturaren zero absolutura iristeko ezintasunari buruzko naturaren lege estatistikoa da. Lege honek erreferentzia-puntu absolutua ematen du entropia zehazteko. Puntu honi dagokionez, entropia determinatua entropia absolutua da. Ordezko definizioek honako hauek biltzen dituzte: "sistema guztien eta sistema baten egoera guztien entropia txikiena da zero absolutuan", edo, bestela, "ezinezkoa da tenperaturaren zero absolutura iristea edozein prozesu-kopuru finituren bidez"[15].
Zero absolutua -273,15 ° C da (Celsius graduak), edo -459,67 ° F (Fahrenheit graduak), edo 0 K (kelvin), edo 0 ° R (Rankine graduak).
Sistema termodinamikoak[aldatu | aldatu iturburu kodea]
Sistema, aztertu nahi den unibertsoaren zatia bezala definitzen da. Objektu bakar bat bezain sinplea izan daiteke, edo instalazio petrokimiko oso bat bezain konplexua. Barruan duen materiaren osaketa aldaezina izan daiteke, edo aldakorra erreakzio kimiko eta nuklearrengatik. Itxura, bolumena eta posizioa ere ez dute zertan berdinak izan denbora igaro ahala. Sistemarena ez den gauza orori ingurua deitzen zaio, eta inguruak eta sistemak osatzen duten multzoari unibertsoa. Sistema eta ingurua bereizten dituen gainazalari muga deritzo, bai benetakoa ala itxurazkoa izan. Muga honen bitartez sistemak inguruarekin elkarreragiten du. Sistemak hainbat erakoak izan daitezke:
- Sistema itxiak: materiak ezin dezake muga zeharkatu.
- Sistema irekiak: materiak muga iragan dezake.
- Sistema isolatuak: inguruarekin elkarreraginik ez dutenak. Ez energiak ezta materiak ezin dezakete muga zeharkatu, ondorioz sistema itxiak izan behar dute.
- Sistema adiabatikoak: ez beroak ezta materiak ezin dezakete muga igaro.
- Sistema deformaezinak: bi puntu lotzen duen lerroan abiaduren proiekzioak berdinak badira. Solido trinko bat, adibidez.
- Sistema homogeneoak: propietate termodinamiko eta kimikoak uniformeak direnean sisteman zehar, edo jarraian aldatzen direnean puntu batetik bestera.
- Sistema heterogeneoak: propietate termodinamiko eta kimikoak berdinak ez direnean. Sistema hau eratzen duten zati homogeneo bakoitzari fase deitzen zaio.
Propietate termodinamikoak[aldatu | aldatu iturburu kodea]
Aldiune bakoitzean balio bat ezarri diezaiokegun sistema baten ezaugarri bat propietate bat da, sistemaren historia jakin beharrik ez dagoelarik. Adibidez presioa, masa eta bolumena zuzenean neurtu daitezkeen propietateak dira. Propietate baten balioaren aldaketa sistemak prozesu bat jasaten duenean hasiera eta amaierako egoeren menpe soilik dago, ez egin den bidearen menpe. Matematikoki propietate bat diferentzial zehatz bat dela esan nahi du. Y propietatea bada eta Xi (i = 1,2,...,k) sistemaren egoera zehazten duten propietateak, hurrengoa idatzi daiteke:
deribatu gurutzatuen berdintasuna betetzen delarik:
Bidearen menpe ez dagoenez, sistemak prozesu bat jasan ondoren hasierako egoerara itzultzen bada propietateak berdinak izan behar dira. Beraz, aurrekoa adierazteko beste modu bat
da. Y ez balitz propietatea eta bidearen menpe balego, ez lirateke aurreko ekuazioak beteko.
Propietate intentsiboak[aldatu | aldatu iturburu kodea]
Propietate bat intentsiboa da sistemaren materia kantitatearen menpe ez badago. Honen adibide presioa eta tenperatura izan daitezke.
Propietate estentsiboak[aldatu | aldatu iturburu kodea]
Propietate estentsiboak sistemaren materia kantitatearen araberakoak dira. Hau da, sistema baten propietate estentsibo bat berau eratzen duten azpisistemen propietateen batura izango da. Adibidez, masa, entropia eta energia sistemaren materia kantitatearen menpe daude. Honelako propietate bat sistemaren masagatik zatitzen bada propietate intentsibo bihurtzen da eta propietate espezifiko izena hartzen du. Hala nola, bolumen espezifikoa sistemaren bolumenaren eta masaren arteko zatidura da.
Matematikoki, propietate estentsiboak lehenengo mailako funtzio homogeneoak dira, eta intentsiboak zero mailakoak.
Egoera, prozesuak eta oreka[aldatu | aldatu iturburu kodea]
Propietateen balioek sistemaren egoera bat zehazten dute. Egoera hau definitzen duten propietateen kopurua finitua da. Propietate bat edo gehiagoren balioak aldatzen direnean egoera aldatzen da eta sistemak prozesu bat jasan duela esaten da.
Oreka termodinamikoak mekanikoak baino zentzu zabalagoa dauka, oreka termikoa, faseen oreka eta oreka kimikoa ere kontuan hartzen baititu. Sistema bat orekan dagoenean ezin du egoeraren berezko aldaketa bat jasan inguruaren egoera ez bada aldatzen. Sistema bat orekan dagoen jakiteko, ingurutik isolatzen da eta propietateen aldaketa behatzen da. Propietateen balioak ez badira aldatzen sistema oreka egoeran dago. Prozesu batean, oreka egoera hau aldatu egiten da desoreka eraginez amaierako egoera arte. Horregatik, termodinamikan prozesu ia-estatikoa deitzen den prozesu ideala oso erabilia da. Prozesu honetan orekatik desbideratzea asko jota infinitesimala da, eta sistemaren egoera guztiak oreka egoeratzat hartu daitezke. Prozesu erreal bat ia-estatikotzat hartzeko, prozesuak irauten duen denborak erlaxazio-denbora baino askoz handiagoa izan behar du, erlaxazio-denbora propietate bat aldatu eta sistemak berriz oreka lortzen duen arteko denbora delarik. Horrela, prozesuaren edozein etapan sistemari denbora ematen dio oreka lortzeko eta prozesua, guztira, beraien artean oso hurbil dauden oreka egoeren segida da.
Prozesu termodinamikoak[aldatu | aldatu iturburu kodea]
Prozesua itzulgarriak edo itzulezinak izan daitezke. Lehenengo kasuan, bai sistema baita ingurua ere hasierako egoerara bihurtuak izan daitezke prozesua inbertitzen bada. Prozesu erreal guztiak itzulezinak dira, itzulezintasunen bat dutelako, bai termikoa, mekanikoa edo kimikoa.
- Prozesu isotermoa: tenperatura konstantean gertatzen direnei deritze.
- Prozesu isobaroa: presio konstantean gertatzen direnei deritze.
- Prozesu isokoroa: boluen konstantean gertatzen direnei deritze.
- Prozesu adiabatikoa: bero transferentziarik gabe gertatzen direnei deritze.
- Prozesu isoentropikoa: prozesu adiabatiko eta itzulgarriei deritze, haietan entropia aldaketarik gertatzen ez baita.

Carnoten zikloa presio eta bolumen diagrama batetan adierazita
Prozesu baten hasierako eta amaierako egoera berdinak badira, sistemak ziklo termodinamiko bat jasan du. Zikloa amaitzean propietateen balioak berdinak dira.
- Carnoten zikloa: prozesu isotermo eta adiabatikoe pareak osatzen dute.
- Rankine zikloa: zentral termikoetan erabiltzen dena, uraren lurruntze eta kondentsazio prozesuetan oinarritzen da (prozesu isotermoak).
- Diesel zikloa: motoretan erabiltzen dena, erregaien konbustioan oinarritzen da (prozesu isokoroa).
Potentzial termodinamikoak[aldatu | aldatu iturburu kodea]
Zenbait funtzio aldagai natural deituriko aldagaietan adierazi daitezke, eta sistemaren egoeraren deskribapena ematen badute, potentzial termodinamikoak deitzen dira. Sistemak gordea duen energiaren neurria dira. Lau ezagunenak hurrengoak dira:
| Barne energia | |
| Helmholtz energia askea | |
| Entalpia | |
| Gibbs energia askea | |
| Entropia |
Parentesi artekoak aldagai askeak dira sistema arrunt baten kasuan, T tenperatura, S entropia, p presioa, V bolumena eta N partikula kopurua direlarik.
Erreferentziak[aldatu | aldatu iturburu kodea]
- ↑ (Ingelesez) Clausius, Rudolf Julius Emanuel. (1960). On the Motive Power of Heat, and on the Laws which Can be Deduced from it for the Theory of Heat. Dover (Noiz kontsultatua: 2023-04-04).
- ↑ (Ingelesez) Kelvin, William Thomson Baron. (1882). Mathematical and Physical Papers. University Press (Noiz kontsultatua: 2023-04-04).
- ↑ (Ingelesez) Rudolf Clausius. (1867). The Mechanical Theory of Heat: With Its Applications to the Steam-engine and .... J. Van Voorst (Noiz kontsultatua: 2023-04-04).
- ↑ Van Ness, H. C.. (1983). Understanding thermodynamics. (Dover edition. argitaraldia) Dover Publications, Inc ISBN 978-1-62198-625-6. PMC 849744641. (Noiz kontsultatua: 2023-04-04).
- ↑ Dugdale, J. S.. (1996). Entropy and its physical meaning. Taylor & Francis ISBN 0-7484-0568-2. PMC 36457809. (Noiz kontsultatua: 2023-04-04).
- ↑ (Ingelesez) Smith, J. M.. (1950-10). «Introduction to chemical engineering thermodynamics» Journal of Chemical Education 27 (10): 584. doi:. ISSN 0021-9584. (Noiz kontsultatua: 2023-04-04).
- ↑ Haynie, Donald T.. (2001). Biological thermodynamics. Cambridge University Press ISBN 0-511-04118-7. PMC 56130244. (Noiz kontsultatua: 2023-04-04).
- ↑ Perrot, Pierre. (1998). A to Z of thermodynamics. Oxford University Press ISBN 0-19-856556-9. PMC 38073404. (Noiz kontsultatua: 2023-04-04).
- ↑ Cardwell, D. S. L.. (1971). From Watt to Clausius: the rise of thermodynamics in the early industrial age,. Heinemann Educational ISBN 0-435-54150-1. PMC 240805. (Noiz kontsultatua: 2023-04-04).
- ↑ Çengel, Yunus A.. (2006). Thermodynamics : an engineering approach. (5th ed. argitaraldia) McGraw-Hill Higher Education ISBN 0-07-288495-9. PMC 58789937. (Noiz kontsultatua: 2023-04-04).
- ↑ Connecticut Academy of Arts and Sciences. (1866). Transactions. New Haven (Noiz kontsultatua: 2023-04-04).
- ↑ Gibbs, J. Willard. (1993-). The scientific papers of J. Willard Gibbs : in two volumes.. Ox Bow Press ISBN 0-918024-77-3. PMC 27974820. (Noiz kontsultatua: 2023-04-04).
- ↑ (Ingelesez) Lewis G. N., Randall M.. (1923). Thermodynamics and the free energy of chemical substances. MGH (Noiz kontsultatua: 2023-04-04).
- ↑ Klotz, Irving M.. (2008). Chemical thermodynamics : basic concepts and methods. (7th ed. argitaraldia) Wiley ISBN 978-0-471-78015-1. PMC 237098728. (Noiz kontsultatua: 2023-04-04).
- ↑ (Ingelesez) Heidrich, Matthias. (2016-10-01). «Bounded energy exchange as an alternative to the third law of thermodynamics» Annals of Physics 373: 665–681. doi:. ISSN 0003-4916. (Noiz kontsultatua: 2023-04-04).
Bibliografia[aldatu | aldatu iturburu kodea]
- Goldstein, Martin; Inge F.. (1993). The Refrigerator and the Universe. Harvard University Press ISBN 978-0-674-75325-9. OCLC .32826343. A nontechnical introduction, good on historical and interpretive matters.
- Kazakov, Andrei; Muzny, Chris D.; Chirico, Robert D.; Diky, Vladimir V.; Frenkel, Michael. (2008). Web Thermo Tables – an On-Line Version of the TRC Thermodynamic Tables. doi:. ISSN 1044-677X. PMID 27096122..
- Gibbs J.W.. (1928). The Collected Works of J. Willard Gibbs Thermodynamics.. New York: Longmans, Green and Co.. Vol. 1, pp. 55–349.
- Guggenheim E.A.. (1933). Modern thermodynamics by the methods of Willard Gibbs. London: Methuen & co. ltd..
- Denbigh K.. (1981). The Principles of Chemical Equilibrium: With Applications in Chemistry and Chemical Engineering.. London: Cambridge University Press.
- Stull, D.R., Westrum Jr., E.F. and Sinke, G.C.. (1969). The Chemical Thermodynamics of Organic Compounds.. London: John Wiley and Sons, Inc..
- Bazarov I.P.. (2010). Thermodynamics: Textbook.. St. Petersburg: Lan publishing house ISBN 978-5-8114-1003-3.. 5th ed. (in Russian)
- Bawendi Moungi G., Alberty Robert A. and Silbey Robert J.. (2004). Physical Chemistry. J. Wiley & Sons, Incorporated.
- Alberty Robert A.. (2003). Thermodynamics of Biochemical Reactions. Wiley-Interscience.
- Alberty Robert A.. (2006). Biochemical Thermodynamics: Applications of Mathematica. John Wiley & Sons, Inc. ISBN 978-0-471-75798-6. PMID 16878778..
- Dill Ken A., Bromberg Sarina. (2011). Molecular Driving Forces: Statistical Thermodynamics in Biology, Chemistry, Physics, and Nanoscience. Garland Science ISBN 978-0-8153-4430-8..
- M. Scott Shell. (2015). Thermodynamics and Statistical Mechanics: An Integrated Approach. Cambridge University Press ISBN 978-1107656789..
- Douglas E. Barrick. (2018). Biomolecular Thermodynamics: From Theory to Applications. CRC Press ISBN 978-1-4398-0019-5..











