Lankide:Ane.bailo/Proba orria
Atomoa (grezieraz άτομον, zatiezina)[1] materiaren oinarri den egitura mikroskopikoa da. Atomo bat ezin da metodo kimikoen bitartez zatitu. Atomoaren existentzia Demokrito filosofoak proposatu zuen lehenengoz K.a V. mendean.[2]
Solido, likido, gas zein plasma guztiak, atomo neutro edo ionizatuz osatuak egon daitezke. Atomoak oso partikula txikiak dira, 100 pikometro (= 1 Å) ingurukoak.[3] Beraien tamaina zehaztasun osoz definitzea ez da batere erraza. Izan ere, atomoak hain txikiak izanik kanpo-forma ez dago ongi definitua. Hala ere, mota ezberdinetako tamaina-neurketak burutu ostean balio antzekoak lortu izan dira.

Fisikak izan duen garapenari esker, printzipio kuantikoak erabili dira eredu atomikoa azaldu eta atomoek duten portaera aurreikusi ahal izateko.
Atomo bakoitza nukleo batez eta honen inguruan dabiltzan elektroien bidez osatuta dago. Nukleoa gutxienez protoi batez eta normalen neutroi kopuru berdinaz osatzen da. Nukleoan dauden partikulei nukleoi deritze eta atomo-masaren % 99,94 baino gehiago bertan kokatua dago.
Atomo baten nukleoaren tamaina, atomo osoaren tamaina baino 100.000 aldiz txikiagoa da, baina hala ere, masa atomiko gehiena nukleoan gordetzen da. Proportzioen inguruko ideia bat egitearren, atomo osoa futbol-zelai bat balitz, erdian jarritako dilista baten tamainakoa izango litzateke nukleoa eta gainontzeko espazio guztia hodei elektroniko bat izango litzateke.
Hurrengo taulan, partikula bakoitzaren ezaugarriak ematen dira: izena, karga eta masa.
| Karga | Masa | |
| Protoia | Positiboa, 1,6·10-19 C | Handia, 1,67·10-27 Kg |
| Neutroia | Neutroa | Handia, 1,67·10-27 Kg |
| Elektroia | Negatiboa, -1,6·10-19 C | Txikia, 9,1·10-31 Kg |
Protoien karga elektrikoa, positiboa da, elektroiena berriz, negatiboa. Bestalde neutroiak bi karga motak dituztenez, elkar konpentsatzen dira partikula neutroak osatuz. Atomo batean protoi eta elektroi kopurua berdina bada, atomoa neutroa izango da. Aldiz, atomo batek elektroi gehiago edo gutxiago baditu protoiak baino, atomoa kargatua geratuko da. Kargatutako atomoei ioi deritze. Ioien artean bi mota bereizten dira: katioia eta anioia. Elektroiak galtzen dituzten atomoak positiboki kargatuak geratzen dira eta katioi izena hartzen dute. Aldiz, anioiei alderantzizkoa gertatzen zaie, elektroiak irabazten dituztenez, negatiboki kargatuak geratzen dira.
Egitura atomikoa[aldatu | aldatu iturburu kodea]
Partikula azpiatomikoak[aldatu | aldatu iturburu kodea]
Sakontzeko, irakurri: «Partikula azpiatomikoak»
Atomoa partikula zatiezin bezala definitzen bada ere, errealitatean atomoa partikula azpiatomikoz osatua dago; protoiez, neutroiez eta elektroiez. Protoiak eta neutroiak, nukleoi gisa ere ezagutzen dira, atomoaren nukleoa osatzen dutelako.
Elektroiak, lehen aipatu bezala, atomoa osatzen duten partikula arinenak dira. Karga elektriko negatiboa dute eta haien azpiegitura arbuiagarria denez, funtsezko partikula gisa kontsideratzen dira.
Bestalde, neutroiak eta protoiak ez dira funtsezkoa partikulak. Protoia u motako bi quark-ez eta d motako quark batez osatua dago. Neutroia berriz, d motako bi quark-ez eta u motako batez osatzen da. Quark-ak elkarrekintza nuklear bortitz baten ondorioz mantentzen dira elkartuta, gluoien bidez neurtzen dena.
Atomoaren nukleoa[aldatu | aldatu iturburu kodea]
Sakontzeko, irakurri: « Atomoaren nukleoa »
Atomoak nukleoan duen protoi kopuruari zenbaki atomiko (Z) deritzo eta honen arabera antolatzen da gaur egungo elementu kimikoen taula periodikoa. Bestalde, zenbaki masikoa (A) nukleoko protoi eta neutroien kopurua da.[4]
Elementu kimiko beraren atomo guztiek protoi kopuru bera dute, baina ez dute zertan neutroi kopuru berbera eduki. Isotopo deitzen zaie protoi kopuru bera, baina neutroi kopuru ezberdina duten atomoei. Azken finean, elementu kimiko baten aldaerak dira. Hori dela eta, elementu beraren isotopo desberdinek, protoi kopuru bera izango dute, baina neutroi kopuru ezberdina.
Elektroi-hodeia[aldatu | aldatu iturburu kodea]
Sakontzeko, irakurri: « Elektroi-hodeia »

Atomoaren elektroiak protoien indar elektromagnetikoagatik erakarriak izaten dira. Nukleotik zenbat eta gertuago egon, orduan eta erakarpen-indar handiago jasaten dute. Beraz, elektroiak bertatik askatzeko aplikatu beharreko kanpo-indarrak handiagoa izan beharko du.
Elektroiak aldi berean partikulen propietateak eta uhinen propietateak dituzte eta nukleoaren inguruan uhin geldikorrak osatzeko ohitura dute. Uhin horietako bakoitza orbital atomiko batekin lotzen da. Funtzio matematiko horrek, espazioko puntu zehatz batean elektroi bat aurkitzeko probabilitatea adierazten digu. Elektroi-hodeia, uhin horiek betetzen duten eremuari deritzo, nukleoaren inguruko karga negatibo gisa adieraz daitekeena.
Orbital bakoitzari energia maila bat dagokio. Pauliren bazterketa printzipioak orbital bakoitzean, elektroi bat baino gehiago egotea debekatzen du. Energia-maila desberdinen artean trantsizioak gerta daitezke: elektroi batek energia fotoi nahiko bat xurgatzen badu, maila handiagoko orbital batera salto egin dezake; eta alderantziz, maila altuko batetik baxuagoko batera pasa daiteke, energia fotoi bat igorriz.
Propietate atomikoak[aldatu | aldatu iturburu kodea]
Masa[aldatu | aldatu iturburu kodea]
Masaren zati nagusia atomoaren nukleoan dago, protoiak eta neutroiak direlako partikula pisutsuenak. Elektroiek ere badute pisu nahiz eta 1839 aldiz txikiagoa izan. Erabiltzen diren masa-unitateak, masa atomikoaren unitatea (u bidez adierazia) edo Daltona (Da bidez adierazia) dira. Masa atomiko unitatea (u) karbono-12 atomo askearen masa hamabirena da, 6 protoi eta 6 neutroi dituena eta 1,66 · 10−27 kg-ren baliokidea.
Kimikan masa atomiko unitatea erabiltzeaz gain, mol-a ere erabiltzen da. Edozein elementuren atomo mol bat 6,022 · 1023 (Avogadroren zenbakia) atomori dagokio. Ondorioz, masa atomikoa 1u duen elementu baten atomo mol batek, gramo bat pisatuko du gutxi gorabehera.
Tamaina[aldatu | aldatu iturburu kodea]
Sakontzeko, irakurri: « Erradio atomiko »
Atomoaren kanpo-mugak ez daude argi zehaztuta eta ondorioz elektroi-hodeien tamaina eman izan zaio atomoari, baina hauen uhin-propietatea dela eta ez da guztiz zehatza. Praktikan, erradio atomikoa definitzeko, bolumen zehatz bateko atomo kantitatea edota dentsitatea bezalako fenomeno fisikoak erabiltzen dira. Erabiltzen den beste metodo bat, molekula baten bi nukleoen arteko distantzia kalkulatzea da.
Elementu bakoitzak tamaina desberdin bat du. Taula periodikoan begiratuz, ilaran eskuinerantz mugitzen bagara, hau da, periodo berean; erradio atomikoa txikitu egiten da. Izan ere, zenbat eta eskuinerago egon taulan, orduan eta protoi gehiago daude. Beraz, periodoan zehar atomoek energia-maila bereko elektroiak dituztenez eta protoi kantitatea handitzen denez, elektroiak indar handiagoz erakarriko ditu nukleoak.
Aldiz, talde berean, hau da, zutabean; beherantz egiten badugu, erradio atomikoa handituko da. Kasu honetan, energia-mailak handituz doaz zutabean behera egitean. Ondorioz, nahiz eta protoiak gehiago izan, elektroiak urrunago egongo dira nukleotik erakarriak izateko, eta beraz, erradioa handiagoa izango da.
Energia mailak[aldatu | aldatu iturburu kodea]

Atomo bati loturik dagoen elektroi batek energia potentzial bat du, nukleoaren distantziarekiko proportzionala eta zeinu negatibokoa izango dena. Energia honen magnitudeak, elektroia atomotik askatzeko zenbat energia aplikatu behar den adieraziko digu, eta elektronvoltetan neurtzen da (eV).
Atomo batek eduki dezakeen energia minimoa funtsezko egoeran dagoenekoa da. Energia jasotzen badu, egoera kitzikatu batean dagoela esaten da. Egoera horretan, azken mailako elektroiak energia jaso dutez, gehiegizko energia dute eta energia-maila handiagoko orbital batera pasa daitezke. Bestalde, egoera kitzikatu batetik berriro ere funtsezko egoerara itzultzeko, atomoak energia igorri beharko du.
Beraz, atomoak bi egoeren arteko trantsizioan daudenean, fotoi bat igorri edo xurgatzen dute. Fotoi baten energia, maiztasunarekiko proportzionala izango da eta trantsizio bakoitza espektro elektromagnetiko banda estu bati dagokio, espektro-lerro deitua.
Elementu kimiko bakoitzak bere espektro-lerroa karakteristikoa du.
Teoria atomikoaren historia[aldatu | aldatu iturburu kodea]

Atomoaren kontzeptua Antzinako Greziatik dator, Demokrito, Leucipo eta Epicuroren eskutik. Haatik, kontzeptu hau ez zuen esperimentazioak sortu, behar filosofiko batek baizik. Nolabait azaldu behar zuten garai hartako filosofoek, materia ezin zela nahi adina aldiz zatikatua izan eta egon beharra zuela zatiezina zen partikularen bat.
Hurrengo aurrerapen garrantzitsua ez zen 1773. urterarte gertatu. Hain zuzen ere, Antoine-Laurent de Lavoisier kimikari frantsesak esan zuen arte materia ez zela ez sortu, ez suntsitzen, eraldatu baizik. Ondoren, 1804. urtean John Dalton izan zen Lavoisierren hitzak frogatu zituena, masa-kontserbazioaren legea sortuz. Horrez gain, Daltonek ondorioztatu zuen, elementu beraren atomoak guztiz berdinak zirela, baina beste elementuekiko desberdinak.
Urte batzuk beranduago, 1811.ean, Amadeo Avogadro fisikari italiarra iritsi zen. Avogadroren arabera, tenperatura, presio eta bolumen zehatz batean gas batek beti edukiko du partikula kopuru bera, atomo zein molekula, gasaren jatorria edozein delarik ere.
Dmítri Ivánovich Mendeléyev kimikariak, 1869. urtean elementu kimikoen sailkapen bat egin zuen, elementuak masa atomiko baxuenetik altuenera ordenatuz. Sailkapen hau egin zuenean ohartu zen, propietate kimikoak aldizka errepikatzen zirela. Mendeléyevek egin zuen lan hura, gaur egungo taula periodikoaren aurrendaria izan zen.[5]
Atomoak barrutik zuen itxura jakin ahal izateko 1911. urteko Rutherforden esperimentuari itxaron behar izan zitzaion. Horrela, Rutherforden eredu atomikoa zabaldu zen. Ondoren, Bohr-ek hobetu zuen, eta azkenik denboraren poderioz, teoria kuantikoari esker eta teknologiaren garapenagatik zehaztasun handiagoz joan gara ezagutzen atomoaren barneko itxura.[6]
Eredu atomikoaren eboluzioa[aldatu | aldatu iturburu kodea]

Atomoaren sortzeari buruz eduki den ikuskera historian zehar aldatuz joan da, fisika eta kimika alorretan egin diren aurrerapenengatik. Jarraian, historian zehar, garai ezberdinetako zientzialariek proposatu izan dituzten eredu atomikoei buruz hitz egingo da. Hauetako batzuk, gaur egun aztertzen diren fenomenoak azaltzeko zaharkituak geratu dira.
Daltonen eredua (1803)[aldatu | aldatu iturburu kodea]
Sakontzeko, irakurri: « Daltonen eredu atomikoa »

Oinarri zientifikoak izan zituen lehen eredu atomikoa John Daltonek proposatu zuen 1803. urtean. Daltonek atomoak esfera nimiño gisa imajinatzen zituen.[7] Lehen eredu atomiko honek honakoa zioen:
- Materia atomo izeneko partikula zatiezin, suntsiezin eta oso txikiz osatua dago.
- Elementu kimiko beraren atomoak elkarren artean berdinak dira, masa eta propietate berekoak. Aldiz, elementu kimiko bakoitzak atomo ezberdinak ditu.
- Erreakzio kimikoak gertatzen direnean, atomoa konbinatzen badira ere, zatiezinak izaten jarraitzen dute.
- Atomoak konposatu kimikoak sortzeko konbinatzen direnean erlazio sinpleak mantentzen dituzte.
- Elementu ezberdinen atomoak proportzio ezberdinetan konbinatu daitezke konposatu ezberdinak eratzeko.
- Konposatu kimiko bat sortzen da bi elementu edo gehiagoren arteko bateratzea gertatzen bada.
Alabaina, Daltonek izpi katodikoak, erradioaktibitatea, eta elektroi eta protoien inguruko ezer azaltzen ez zuenez, Thomsonen eredua heldu zenean desagertu egin zen eredu hau.
Thomsonen eredua (1897)[aldatu | aldatu iturburu kodea]
Sakontzeko, irakurri: « Thomsonen eredu atomikoa »

Joseph John Thomsonek 1897an egin zuen elektroiaren aurkikuntzari esker, materia bi zatitan banatua zegoela zehaztu zen, bata negatiboa eta bestea positiboa zena. Zati negatiboa elektroiez osatutakoa zen eta Thomsonen arabera, elektroi horiek karga positibodun masa batean murgildurik zeuden. Mahaspasak bizkotxo batean egongo balira bezala. Beranduago, Jean Perrinek Thomsonen eredua eraldatu zuen, esanez, mahaspasak (elektroiak) bizkotxoan (zati positiboan) murgilduta egon ordez, kanpoaldean bakarrik zeudela.
Eredu honetan, ioi positibo zein negatiboak nola sortzen ziren azaldu zuen Thomsonek. Haren arabera, karga negatibodun partikulak nahikoak zirenean atomoaren karga positiboa konpentsatzeko, atomoa neutroa zen. Ondorioz, atomoak elektroi bat galtzen zuenean, atomoa positiboki kargatuta geratuko zela zioen eta aldiz, elektroi bat irabaztean negatiboki. Modu honetan, ioiak nola sortzen ziren azaldu zuen. Aitzitik, azaldu gabe utzi zituen bestelako erradiazioen existentzia.
Nagaokaren eredua (1904)[aldatu | aldatu iturburu kodea]

Sakontzeko, irakurri: « Nagaokaren eredu atomikoa »
Nagaoka fisikariak, Thomsonen eredua deuseztatu zuen. Izan ere, Nagaokak arrazoitu zuen, karga bat ezin zela aurkako karga elektriko batez zeharkatua izan. Desadostasun horren aurrean, Nagaokak bere eredu alternatiboa proposatu zuen, non, atomoaren zentroan karga positibo bat zegoen eta bere inguruan elektroiak zebiltzan biraka. Hain zuzen ere, Saturno eta bere eraztunak erabili zituen antzekotasun gisa.
Gauzak horrela, 1904an Nagaokak atomoaren lehen eredu planetarioa garatu zuen, Rutherforden antzekoa. Lehen esan bezala, Nagaokaren eredua, Saturno planeta masiboaren eta bere inguruko eraztunen arteko egonkortasunean, eta erlazio grabitatorioen analogian oinarritua zegoen. Izan ere, Nagaokaren ustez, Saturnoren eraztunak oso egonkorrak ziren Saturno planeta masiboaren inguruan biratzen zutelako.
Horrek atomora itzuliz bi aurreikuspen zekartzan:
1. Nukleo masibo baten existentzia (planetaren analogian)
2. Indar elektrostatiko baten ondorioz nukleo atomiko horri lotuta, nukleoaren inguruan biraka ibiliko ziren elektroiak egongo zirela (saturnoren eraztunei analogia eginez).
Rutherforden eredua (1911)[aldatu | aldatu iturburu kodea]

Sakontzeko, irakurri: « Rutherforden eredu atomikoa »
Eredu hau Ernest Rutherforden eskutik garatu zen. Eredu honen emaitzak 1911.urtean lortu ziren eta gaur egun Rutherforden esperimentu moduan ezagutzen dira. Thomsonen ereduarekiko aurrerapenak zekartzan Rutherfordek.
Thomson bezalaxe, Rutherford ere bat zetorren atomoa zati positibo eta negatibo batez osatua zegoelako ideiarekin. Bestalde, Thomsonekiko desberdinduz, aldarrikatu zuen zati positibo guztia nukleoan kontzentraturik zegoela eta bera zela “birtualki” atomoaren masa guztiaren jabe. Horrez gain, nukleoaren gainazalaren inguruan elektroiak orbita eliptiko edo zirkularretan orbitatzen zutela zioen, eta haien arteko espazioa hutsa zegoela.
1920.urtean, Rutherfordek neutroiaren existentzia iragarri zuen.
Zoritxarrez, eredu atomiko honek ere zenbait ideien artean koherentzia falta zuen. Batetik, James Clerk Maxwellen elektromagnetismoaren arauarekin kontraesanak zituen eta azken haiek, datu esperimentalen bidez egiaztatuta zeuden. Bestetik, Rutherfordek ez zituen espektro atomikoak azaldu.
Bohren eredua (1913)[aldatu | aldatu iturburu kodea]
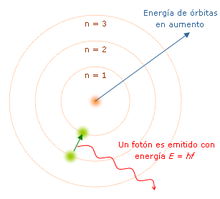
Sakontzeko, irakurri: « Bohrren eredu atomikoa »
Eredu hau, 1913an Rutherforden eredutik abiatuz, hidrogenoarentzat hertsiki sortutako eredua zen. Eredu honetan, Niels Bhor absortzio eta gasen emisio fenomenoak txertatzen saiatu zen. Era berean, Max Plancken energiaren kuantizazio lege berria eta Albert Einsteinen efektu fotoelektrikoaren fenomenoak ere gehitu nahi izan zituen.
«Atomoa eguzki-sistema txiki bat bezalakoxea da, nukleo bat du erdigunean eta elektroiak dabiltza nukleo horren inguruan, zehazki definiturik dauden orbitetan». Orbitak kuantizatuta daude eta elektroiak orbita zehatz batzuetan soilik egon daitezke.
- Orbita bakoitzak energia kantitate bat du.
- Elektroiek ez dute energia (argia) igorriko orbita egonkor batean mantentzen diren bitartean.
- Elektroiak orbita batetik bestera salto egin dezakete. Salto hori, energia gutxiko orbita batetik energia gehiagoko orbita batera egiten badu, energia kantitate bat jaso beharko du, hain zuzen, orbiten arteko energia diferentziari dagokiona. Aitzitik, energia handiko orbita batetik gutxiagoko batera pasatzen bada elektroia, energia galduko du erradiazio moduan (argia emanez).
Bohren arrakasta handiena, hidrogenoaren emisio espektroa azaltzea izan zen. Izan ere, elementu honen argiak bakarrik ematen zuen horretarako aukera. Fotoia elektroi bat orbita batetik bestera erortzean igortzen zen, energia-pultsu baten moduan erradiatuz.
Bestalde, ez zen gai izan orbita egonkorren existentzia eta kuantizazioa nolakoa zen azaltzeko.
Horrez gain, elektroiaren momentu angeluarra h/2π zela aurkitu zuen, baina hau ere ez zen gai izan justifikatzeko.
Sommerfelden eredua (1916)[aldatu | aldatu iturburu kodea]

Sakontzeko, irakurri: « Sommerfelden eredu atomikoa »
Sommerfeldek zioen Bohren eredu atomikoa oso egokia zela hidrogeno atomoaren kasurako. Aldiz, beste elementu batzuen atomoen espektroak osatzerakoan aztertu zuen maila energetiko bereko elektroiek energia desberdina zutela. Honela, Bohren ereduak erroreren bat zuela aitortu zuen. Beraz, Arnold Sommerfelden konklusioa izan zen, maila energetiko beraren barruan azpimailak egon behar zirela, energia arinki desberdinarekin.
Fisikari alemaniarrak, Albert Einsteinen erlatibitatearen teoriaren laguntzarekin, honako aldaketak egin zizkion Bohren ereduari 1916.urtean:
- Elektroiak nukleoaren inguruan dabiltza orbita zirkular edota eliptikoetan.
- Bigarren maila energetikotik aurrera bi azpimaila energetiko edo gehiago existitzen dira.
- Elektroia korronte elektriko nimiño bat da.
Hortaz, Sommerfelden eredu atomikoa Bohrenaren orokortasun bat da ikuspuntu erlatibista batetik. Bestalde, orbitak zirkularrak izan beharrean eliptikoak zirela aldarrikatu bazuen ere, ez zen gai izan orbita eliptikoetan emisioa nola gertatzen zen azaltzeko.
Schrödingeren eredua (1926)[aldatu | aldatu iturburu kodea]

Sakontzeko, irakurri: « Schrödingerren eredu atomikoa »
Louis-Victor de Brogliek 1924ean proposatu eta 1926an Erwin Schödingerrek orokortu zuen uhin-partikula dualtasunaren kontzeptuaren ondorioz, berriro ere eguneratu zen eredu atomikoa.
Schrödingerren eredu honetan, elektroiak uhin-funtzio baten bidez deskribatzen dira. Funtzio matematiko horrek, elektroi jakin bat espazioko eskualde zehatz batean egoteko probabilitatea nolakoa den jakitea ahalbidetzen digu. Espazioko eskualde horri orbital deritzo. Ondorengo irudian lehenengo maila energetikoentzako orbitak agertzen dira, hidrogenoaren atomorako.
Diracen eredua (1928)[aldatu | aldatu iturburu kodea]
Sakontzeko, irakurri: « Dirac-en eredu atomikoa »
Dirac-en 1928.urteko ereduan Schrödingerren antzeko suposizioak erabiltzen dira, nahiz eta abiapuntua desberdina izan. Dirac-en abiapuntua uhin-funtzioaren ekuazio erlatibista da, Dirac-en ekuazio deitua. Eredu honek, elektroiaren spin-a modu naturalago batean gehitzea ahalbidetzen du. Dirac-ek Schrödingerren maila energetiko antzekoak aurreikusten ditu, baina zuzenketa erlatibista batzuk eginda.
Ikus, gainera[aldatu | aldatu iturburu kodea]
Erreferentziak[aldatu | aldatu iturburu kodea]
- ↑ «Átomo», en Diccionario de la Lengua Española (22ª ed.). Real Academia Española (2001). Consultado el 20 de julio de 2009.
- ↑ Asimov, I. (2014). Breve historia de la química: Introducción a las ideas y conceptos de la química. Madrid: Alianza Editorial/El Libro de Bolsillo. p. 26. ISBN 978-84-206-6421-7
- ↑ Ghosh, D. C.; Biswas, R. (2002). «Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii». Int. J. Mol. Sci. 3: 87-113. doi:10.3390/i3020087.
- ↑ La fórmula exacta es 1,12 ³√A fm. Véase Cottingham eta Greenwood, 2004, §4.3.
- ↑ Elements and Atoms: Chapter 12: Mendeleev's First Periodic Table (en inglés)
- ↑ Experimento de Rutherford
- ↑ Rincón Arce, Álvaro (1983) ABC de Química Primer Curso, Editorial Herrero, México, ISBN 968-420-294-6.
Bibliografia[aldatu | aldatu iturburu kodea]
- «Teaching Standard Model at high school» (en inglés). Cronología del modelo atómico.
- Sokolovsky, Silvia (2002). «El Átomo»..
- Bransden, B.H.; Joachain, J.C. (1983). Physics of atoms and molecules (en inglés). Longman Group Limited. ISBN 0-582-44401-2.
- Cottingham, W.N.; Greenwood, D.A. (2004). An introduction to nuclear physics (en inglés). Cambridge University Press. ISBN 0-521-65149-2.
- Demtröder, Wolfgang (2006). Atoms, molecules and photons (en inglés). Springer-Verlag. ISBN 978-3-540-20631-6.
- Kramer, Kenneth (1988). Introductory nuclear physics (en inglés). ISBN 047180553X.
- «Los ladrillos del Universo: los bloques constituyentes de la materia». Archivado desde el original el 8 de febrero de 2009. Material divulgativo del CERN.
